Как найти вену у коровы на шее
Опубликовано: 22.04.2024
Лечебно-профилактические мероприятия, как неотъемлемая часть ветеринарного надзора в скотоводческой отрасли, требуют пристального внимания и регулярности. Взятие крови на анализ у КРС является важной профилактической процедурой, от техники выполнения которой зависит достоверность исследования, безопасность окружающих и дальнейшая производительность коров.
Подготовка животного
Забор крови у коров проводят для исследования ее биохимического состава, исключения инфекционных заболеваний или подтверждения предполагаемого диагноза. Венозная кровь необходима для проведения анализа на лейкоз, бруцеллез, туберкулез. Чтобы взять материал у коровы, не причинив вреда здоровью животного, необходимо правильно подготовиться к процедуре. Оптимальное время для забора – утренние часы перед первым кормлением. После приема пищи не рекомендуется брать кровь на анализ в течение 5 часов.
Место для взятия пробы освобождают от волосяного покрова и, при необходимости, фиксируют скотину, после чего участок обрабатывают антисептиком. Для дезинфекции подходит 70 % раствор этилового спирта, 1 % спиртовой раствор салициловой кислоты, 5 % спиртовой раствор йода.
Методики, не требующие принудительной фиксации положения тела, легче переносятся животными. Стресс от проведенной процедуры может привести к снижению удоя. Не рекомендуется брать кровь у самок за 3 недели до отела и в течение 3 недель после родов.
Техника взятия крови у КРС
Забор крови у коров проводят из яремной, хвостовой или молочной вен. Работа в каждой зоне имеет свои особенности, обусловленные различным местоположением и скоростью кровотока.



Из яремной вены
В соответствии с распространенной и устоявшейся методикой взятия крови у коров из яремной вены, используют кровопускательную иглу и стерильную пробирку, в которую набирают жидкость по стенке. Сосуд располагается в нижней трети шеи животного. Голову необходимо зафиксировать, что становится для коровы стрессовым фактором.

Техника забора крови из яремной вены:
- Фиксируют голову животного в неподвижном положении.
- Подготавливают нижнюю треть шейной зоны, удаляя излишки волос, дезинфицируют поверхность кожи спиртовым раствором.
- Зажимают большим пальцем руки сосуд.
- Вводят иглу в вену под острым углом к поверхности в направлении к голове. Глубина введения составляет 1 сантиметр.
- Собирают кровь в пробирку.
Материал, собранный таким способом, не стерилен, жидкость может разбрызгиваться.

Из молочной вены
Молочная вена располагается на животе коровы с двух сторон, сбоку от вымени. Она хорошо заметна у взрослых самок, но процесс забора осложняет высокая чувствительность данного участка тела и более глубокое залегание вены, чем кажется визуально.
Корову необходимо надежно зафиксировать и удерживать, для чего часто требуется не один человек.
Техника забора крови из молочной вены:
- Фиксируют и удерживают животное.
- Удаляют волосяной покров с прилегающей к вене области.
- Обрабатывают участок спиртовым раствором.
- Прощупывают пальцами руки венозный бугорок.
- Вводят иглу внутрь сосуда параллельно поверхности кожи.
- Набирают биоматериал.
Процедура для коровы неприятна и может стать причиной снижения удоев в результате полученного стресса. Сложный и травматичный для животного метод в современных условиях применяется редко.

Из хвостовой вены
Взятие крови из хвостовой вены проходит быстро, не требует принудительной фиксации животного и обычно легко им переносится. Современные методики нацелены на разработку приспособлений для забора материала именно с данного участка тела коровы.
Правила взятия крови из хвостовой вены:
- Берут рукой хвост коровы на середине длины и поднимают его вверх.
- Дезинфицируют спиртовым раствором область 2-5 позвонка и прилегающие участки.
- Берут стерильную иглу или готовую специальную систему в одну руку, другой – держат хвост.
- Вводят иглу перпендикулярно по центру ширины хвоста на расстоянии около 10 сантиметров от его основания. Глубина введения составляет 0,5-1 сантиметр.
- Набирают материал.

Процедура исключает контакт человека с биологическими жидкостями скота, что считают одним из главных достоинств. Трудности при заборе создает медленный кровоток в сосуде, но современные вакуумные системы решают эту проблему, делая процедуру безопасной и эффективной.



Особенности вакуумного забора крови
Использование современных вакуумных систем для забора крови позволяет проводить процедуру КРС быстро и безопасно. Вакуумный способ хорошо работает на хвостовой вене. Процесс не травмирует корову, исключает прямой контакт человека и других животных с биоматериалом.
Система состоит из иглы и шприца-контейнера. Игла, имеющая оптимальный диаметр (обычно 0,9 миллиметра), снабжена клапаном, который исключает вытекание жидкости, что уменьшает вероятность возможных осложнений. Шприц, одновременно выполняющий функцию транспортного контейнера, сделан из прочного пластика. В нем же можно выделить сыворотку или добавить антикоагулянт.
Достоинства вакуумного метода:
- отсутствие необходимости фиксации животного;
- минимизация стрессового фактора для коровы;
- исключение прямого контакта человека с материалом;
- получение стерильной пробы;
- исключение непредвиденного риска распространения инфекции;
- удобство в использовании без переливаний образца в транспортную тару.

Маркировка вакуум-систем включает удобное на практике цветовое кодирование, что позволяет сортировать взятые пробы.
Возможные ошибки
При выполнении стандартной методики взятия крови из яремной вены велика вероятность попадания материала на человека и окружающие предметы. Если животное заражено, возникает риск распространения инфекции. Открытый способ занимает много времени, требует подготовки и предельной аккуратности.
При нарушении правил асептики и техники забора крови полученный образец может не соответствовать требованиям, у коровы могут возникать осложнения в виде абсцессов, гематом. Не рекомендуется форсировать забор во избежание частичного гемолиза кровяных клеток.
ВЕНЫ ТУЛОВИЩА
Вены туловища в основном представлены краниальной и каудальной полыми венами и их ветвями (рис. 311).
Краниальная полая вена — v. cava cranialis у входа в грудную полость образуется: 1) стволом яремных вен — truncus bijugularis, несущих кровь от головы; 2) подмышечными (правой и левой) венами, несущими кровь от грудных конечностей; 3) шейными венами, которые соответствуют артериям, отходящим от подключичных артерий (глубокие шейные, реберно-шейные и позвоночные). Далее краниальная полая вена проходит в краниальной части средостения и принимает кровь из внутренних грудных вен, собирающих ее из вентральной части грудной клетки, и впадает в правое предсердие, образуя венозный синус. У лошади и собаки в этот синус входит еще правая непарная вена, собирающая кровь от межреберных вен. (Венозная система, отводящая кровь от легких, указана при описании малого круга кровообращения).
У крупного рогатого скота наружная и внутренняя яремные вены и подкожная вена плеча образуют общий парный яремный ствол — truncus bijugularis. Подмышечные, реберно-шейные, позвоночные и внутренние грудные вены впадают в краниальную полую вену самостоятельно. Имеется левая непарная вена — v. azygos sinistra, которая собирает кровь от межреберных вен и впадает непосредственно в венечный синус сердца.
У свиней краниальная полая вена расположена непосредственно на рукоятке грудной кости, что является ориентиром для внутривенных пункций и вливаний.

Рис. 311. Вены грудной клетки коровы (по А. П. Васильеву)
У лошадей парные яремные вены и подкожные вены плеча образуют общий ствол и впадают в краниальную полую вену вместе с подмышечными. В нее впадают также парные общие шейно-реберные, позвоночные, внутренние грудные и правая непарная вены.
У собаки с дорсальной части грудной клетки кровь оттекает по правой непарной вене. Наружная и внутренняя яремные вены сливаются в общий ствол.
Каудальная полая вена — v. cava caudalis образуется путем слияния в области пятого-шестого поясничного позвонка парных общих подвздошных и непарной срединно-крестцовой вен. Проходит в брюшной полости под позвоночным столбом справа от аорты до диафрагмы, затем опускается между диафрагмой и тупым краем печени к отверстию полой вены, расположенному в сухожильном центре, диафрагмы, и вступает в грудную полость, где следует в средостении вентрально от пищевода и вливается на уровне венечной борозды в правое предсердие. По ходу каудальная полая вена принимает кровь из почек (парные почечные вены), половых желез (парные яичниковые или семенниковые вены) и стенок брюшной полости (парные поясничные вены). На месте соприкосновения с тупым краем печени в нее впадают печеночные вены, несущие обезвреженную кровь из чудесной венозной сети системы воротной вены печени.
Система воротной вены печени (рис. 312) собирает кровь из желудка, поджелудочной железы, селезенки, тонкой и толстой кишок (за исключением каудального отрезка прямой кишки).

Рис. 312. Воротная вена (по А. И. Акаевскому) коровы (I), собаки (II)
Короткий ствол воротной вены образуется путем слияния желудочно-селезеночной, краниальной и каудальной брыжеечных вен, идет справа и входит в ворота печени, где делится на междольковые вены, а затем на капилляры печеночных долек. Внутри каждой дольки капилляры вливаются в центральную вену дольки. Это начальные участки вен, отводящие кровь из печени в каудальную полую вену. Благодаря такой чудесной венозной сети кровь, оттекающая от желудочно-кишечного тракта, обезвреживается от ток-синов и других вредных веществ.
У новорожденных животных до 12—16-дневного возраста, а у телят промышленных комплексов до 30-дневного возраста отходящий от пупочной вены (перед входом ее в печень) и впадающий в каудальную полую вену сосуд — венозный проток — ductus venosus не облитурирует. Через этот проток у плода и в первые дни жизни у новорожденного кровь транзитом проходит в каудальную полую вену, не попадая в чудесную венозную сеть печени и, таким образом, не проходя фильтрации. Видимо, это обусловлено тем, что с молозивом или молоком матери в это время поступают необходимые для защиты организма иммунные тела, которые, минуя барьер печени, идут в кровь теленка, рождающегося стерильным и не имеющего до 14-дневного возраста своей защитной системы. У новорожденного альбумины и глобулины молозива или молока легко проникают через кишечную стенку в кровь и сразу проходят из воротной вены по венозному протоку, минуя барьер печени, в общий кровоток, обеспечивая защиту организма.
Ветеринарный врач должен помнить о задержке облитурации протока у телят» в условиях гемодинамики, т. е. о временном наличии незаросшего венозного протока воротной вены (первый месяц жизни), в результате чего у теленка не вся кровь проходит барьер печени. Поэтому если корова-мать получает недоброкачественные корма, то токсины, попавшие теленку с молозивом или молоком, по венозному протоку попадают прямо в общий кровоток, минуя фильтр печени, и вызывают интоксикацию организма.
В каудальную полую вену впадают парные почечные вены, представляющие собой очень короткие крупные стволы, выходящие из ворот почки. Рядом с почечными венами проходят небольшие стволы надпочечниковых вен, впадающих в каудальную полую вену. От яичников идет яичниковая вена — v. ovarica, от семенников — семенниковая — v. testicularis. Венозная кровь от них отводится прямо в каудальную полую вену. Венозная кровь от брюшной стенки и поясницы в каудальную полую вену оттекает по сегментальным парным поясничным венам — w. lumbales.
Венозный отток от вымени. Особого внимания у лак-тирующих коров заслуживает венозный отток от вымени, который происходит в обе полые вены — каудальную и краниальную. В краниальном направлении выменные вены — w. uberi собираются в каудальную надчревную поверхностную (молочную) вену — v. epigastrica caudalis superficialis, которая идет под кожей по вентральной брюшной стенке к области мечевидного хряща в виде извилистого шнура. В этом месте она прободает стенку, образуя значительное отверстие под названием «молочный колодец» и впадает во внутреннюю грудную вену — v. thoracica interna, которая по внутренней поверхности реберных хрящей направляется в краниальную полую вену. Молочная вена хорошо видна и вместе с «молочным колодцем» прощупывается, что используется в ветеринарной практике.
В каудальном направлении выменные вены собираются в надчеревно-срамную и далее направляются в наружные и внутренние подвздошные вены, которые, сливаясь, образуют общий ствол подвздошных вен, формирующих в каудальной части поясничного отдела начало каудальной полой вены.
У лошадей каудальная надпочечная поверхностная вена анастомозирует с наружной грудной и наружной срамной венами. Из органов тазовой полости и ее стенок кровь отводится в каудальную полую вену по венам, соименным с артериями, которые впадают в парнорасположенную под крестцовой костью внутреннюю подвздошную вену. Необходимо особое внимание обратить на то, что венозный отток от тазовой части прямой кишки происходит по средней и каудальной венам прямой кишки — w. rectales media et caudales, каудальную полую вену (т. е. из этого отдела прямой кишки кровь не проходит барьер печени). Эта особенность венозного оттока используется в ветеринарной практике при ректальном введении лекарственных веществ в том случае, когда они не должны проходить барьер печени.
Из хвоста кровь оттекает по хвостовым венам — w. caudales, которые затем продолжаются как крестцовые латеральные вены — w. sacrales Iateraies. По хвосту идут парные дорсальные и вентральные хвостовые вены и одна (более крупная) непарная хвостовая вена, идущая под телами хвостовых позвонков (в ветеринарной практике используется для внутривенных инъекций).
Крупных животных фиксируют в стоячем положении, применяя при необходимости накрутку или носовые щипцы. Местом пункции яремной вены у лошади (рис. 53) и жвачных служит граница верхней и средней трети шеи. После подготовки поля операции слегка поднимают голову животного вверх, следя за тем, чтобы не напрягались мышцы яремного желоба. Перед операцией сдавливают большим пальцем левой руки яремную вену ниже места пункции, вена фиксируется, наполняется кровью и становится хорошо заметной. Если вена недостаточно ясно вырисовывается, что бывает у упитанных лошадей, а также при сильном напряжении кожной мышцы шеи, приподнимают голову животного несколько выше, ослабляют закрутку и по-
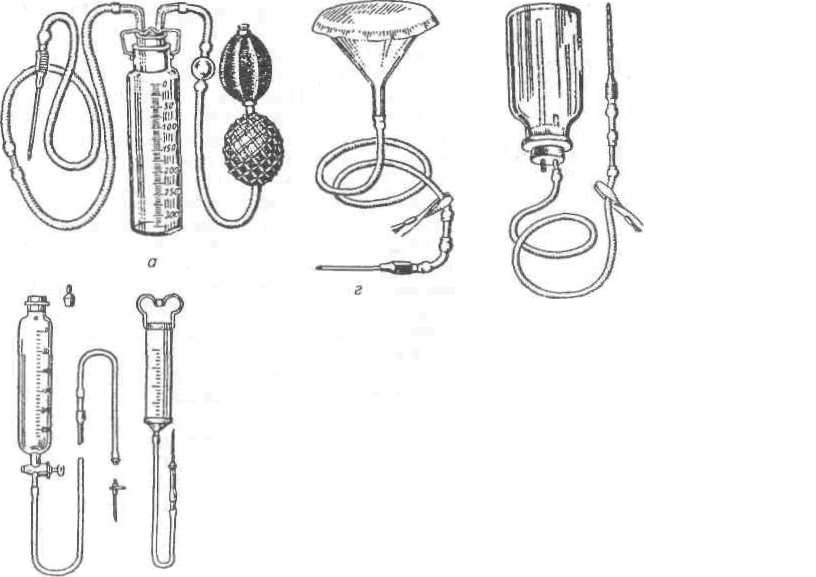
Рис. 52. Приспособления для внутривенных вливаний:
о — аппарат Боброва; б— аппарат Конькова; в — шприц Жанэ; г — воронка; д — бутыль
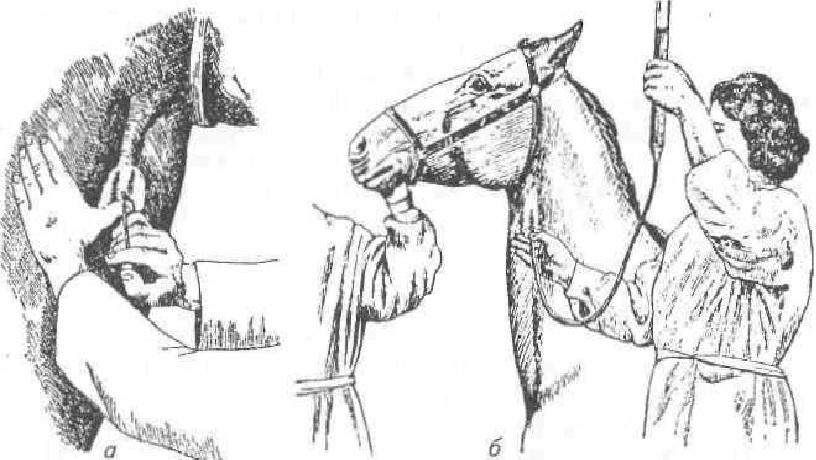
Рис. 53. Пункция яремной вены лошади и внутривенное вливание:
а — держание иглы; 6— общий вид внутривенного вливания
вторно сдавливают вену. В исключительных случаях на шею накладывают резиновый жгут, чтобы максимально прижать вену, особенно у крупного рогатого скота (рис. 54). Не следует делать пункцию, не имея уверенности в местоположении вены.
Во время пункции срез иглы должен быть обращен к коже, в этом случае уменьшается вероятность прокола противоположной стенки вены и закупорки иглы пробкой из кожи. Иглу направляют вверх против тока крови на середине оси вены под углом 40—45° к коже. Если вена плохо видна или толстая кожа, следует вначале ввести иглу под кожу, а затем уже проколоть вену. При попадании иглы в сосуд кровь сразу же начинает вытекать свободной струей через просвет иглы. Если кровь не течет или выделяется кап-

Рис. 54. Пункция яремной вены крупного рогатого скота
лями, что бывает при закупорке просвета иглы, иглу извлекают и повторяют пункцию в новом месте (выше первой точки).
Иглу, наеденную в вену, продвигают на 2—3 см в ее просвет и соединяют с наполненным раствором инфузионным аппаратом, который держат ниже уровня иглы. Как только в аппарате появится кроиь, сю поднимают и, убрав палец с вены (снимают жгут), приступают к вливанию. Раствор вливают со скоростью 30—40 мл в 1 мин, что регулируется высотой поднятия инфузионного аппарата. По завершении вливания инфузионный аппарат опускают ниже, пережимают яремную вену выше места пункции, извлекают иглу и обрабатывают операционное поле.
Внутривенное вливание у свиней. Животных фиксируют в стоячем или лежачем положении. Вливание производят в большую ушную вену. Для выявления ее на основании ушной раковины накладывают резиновый жгут (резиновую трубку) или прижимают вену пальцем. При этом вена наполняется и хорошо вырисовывается. Пункцию осуществляют инъекционной иглой с тонкой эластичной трубкой (рис. 55). Иглу вкалывают под углом 25—30° к направлению основания ушной раковины. После появления из просвета иглы крови к шлангу присоединяют шприц, снимают жгут (или палец с вены), вводят необходимое количество раствора и извлекают иглу. Место инъекции в течение 30 с —1 мин прижимают кусочком ваты, смоченным спиртом, и обрабатывают спиртовым раствором йода.
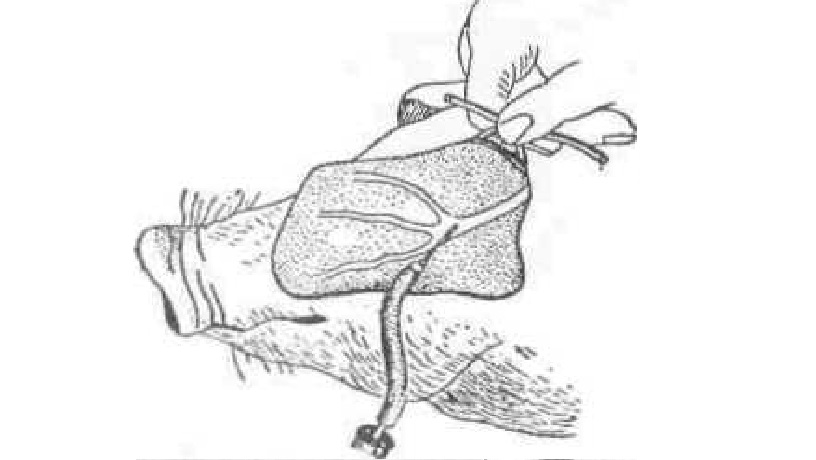
Рис. 55. Пункция большой ушной вены у свиньи
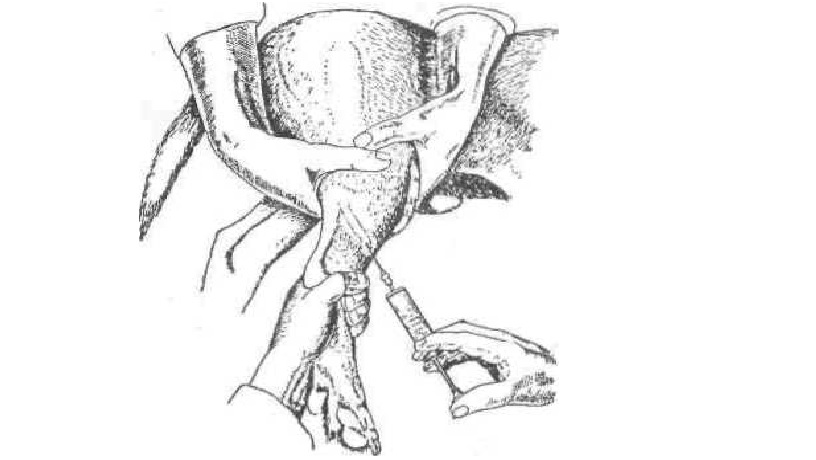
Рис. 56. Пункция плюсневой дорсальной латеральной вены у собаки
Внутривенные вливания у собак и кошек. Животных фиксируют в боковом положении. После подготовки поля операции помощник сдавливает пальцами рук конечность в верхней трети голени или
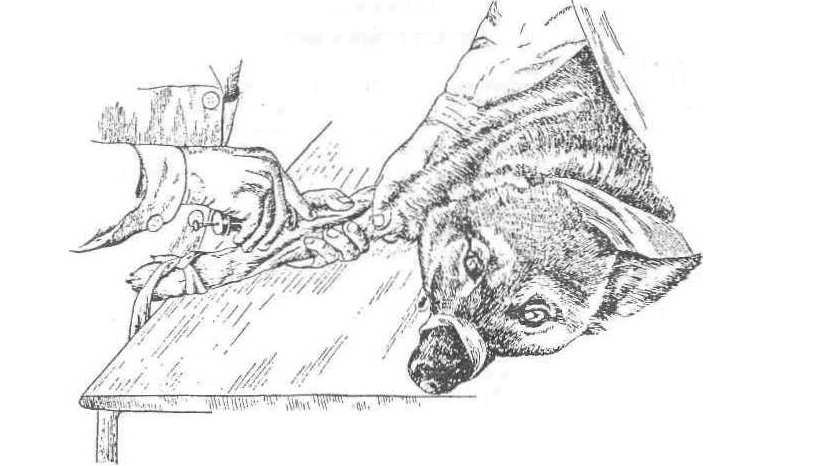
Рис. 57. Пункция вены предплечья у собаки
плеча (рис. 56, 57). Когда вена наполнится кровью и станет более упругой, делают пункцию иглой, присоединенной к шприцу, направляя конец иглы по току крови. При попадании иглы в вену (в шприц поступает кровь) прекращают сдавливание конечности и медленно вводят раствор. После введения место укола прижимают асептическим тампоном, извлекают иглу и обрабатывают место укола раствором йода.
Вливание в подкожную локтевую вену птиц. Вена расположена под кожей в области плеча, предплечья. Вблизи локтевого сустава выщипывают перья. Нажав пальцами выше локтя, находят наполненную вену. Пункцию делают тонкой иглой, присоединенной к шприцу, наполненному вводимым раствором.
Прокол стенки какой-либо полости (грудной, брюшной), а также капсул суставов, бурс сухожильных влагалищ и других полостей делают с диагностической и лечебной целями. Техника выполнения его будет дана в соответствующих разделах.
Биопсия. Биопсией называют иссечение кусочков тканей или органов для микроскопического исследования с целью уточнения диагноза болезни. Она может производиться как во время операции, так и до нее. Полученный кусочек ткани немедленно помещают в 10%-ный раствор формалина (иногда в спирт) и направляют в лабораторию для гистологического исследования. Рану на месте взятого кусочка ткани зашивают.
Петраков К. А., Саленко П. Т., Панинский С. М. Оперативная хирургия с топографической анатомией животных

Из статьи вы узнаете, как брать кровь у крупного рогатого скота, свиней, хранить и стабилизировать биопробы
В ветеринарных лабораториях уточняется диагноз, определяется эффективность обработок, выявляются скрытые патологические процессы… Первым делом отбирается образец (биопроба). Речь идет о крови, продуктах жизнедеятельности (моче и кале), секрете молочной железы, поте, содержимом желудка, рубца и кишечника, тканях, кусочках органов. Чаще исследуется кровь. Именно о ней мы сегодня и поговорим. Вы узнаете, как получают такой материал у разных видов животных, доставляют его в лабораторию.
В силу нестабильности химического состава крови для получения достоверных результатов нужно соблюдать правила отбора и хранения биологического материала.
Нюансы отбора материала
При отборе крови учитывается суточная динамика и соблюдаются правила антисептики. Кровь следует отбирать перед кормлением. Если же животное получило корм, то надо выждать не менее пяти часов. В крови, отобранной раньше, концентрация белка, глюкозы, липидов, лейкоцитов и др. выше физиологической нормы. Пример: норматив по глюкозе в сыворотке крови у КРС – от 2,2 до 3,5 ммоль/л, но если отобрать кровь через час после кормления, значение показателя увеличивается как минимум в два раза.
Один из факторов, определяющих концентрацию минералов, эритроцитов, – время суток. По этой причине материал повторно отбирается в одни и те же часы.
В некоторых случаях взятие пробы невозможно без нарушения целостности тканей. В подобных ситуациях обязательна асептика-антисептика. Лучший антисептик – 70-градусный этиловый спирт. Правда, ветеринары пользуются им, когда есть необходимость во введении туберкулина. Также эффективен спирт-эфир. В крайнем случае пользуются 3-процентной карболовой кислотой.
В стране имеется широкий ассортимент антисептических средств для обработки места прокола (для взятия крови или инъекции). Основа львиной части антисептиков представлена этиловым спиртом, используемым вкупе со вспомогательными бактерицидными компонентами, усиливающими действие.
При выборе препарата нужно руководствоваться составом, ценой и удобством применения. Себя зарекомендовали антисептические спиртовые средства, используемые в виде аэрозолей.
Большое значение имеет анализ крови и лекарства. Материал для анализа отбирается до лечебных мероприятий. Но в любом случае берутся в учет лекарства, которые получало животное. Так, по причине внутривенного введения средства иногда уменьшается количество эритроцитов, гемоглобина… Использование вакцины вызывает лейкоцитоз.
Чем быстрее кровь окажется в пробирке, тем меньше вероятность получения искаженных результатов. На билирубине, витамине В2 отрицательно сказывается свет. Поэтому пользуются светонепроницаемыми пакетами. Допускается временное хранение материала в ящике. При риске разрушения вещества под влиянием кислорода кровь отбирают в пробирку с вазелиновым маслом: так получаемая сыворотка находится под слоем масла и недоступна для воздуха.
Моменты, учитываемые при выборе места отбора крови:
- видовая принадлежность животного;
- размер животного;
- анатомия сосудов (кровь берется из самых доступных вен);
- опыт, личные предпочтения специалиста.
Взятие крови у коровы
У КРС кровь берется из яремной, хвостовой и молочной вен.
Отбор пробы из яремной вены – наиболее популярная процедура, но требует определенной сноровки при нахождении места прокола и при фиксации животного. Корове необходимо тщательно фиксировать голову и шею, что сказывается на доступе к яремной вене.
В плане безопасности кровь лучше брать из хвостовой вены. Правда, в этом случае приходится иметь дело с медленным кровотоком. Такая проблема решается посредством так называемых «пробирок с вакуумом», более тщательной очистки места прокола и опыта. Допустимо использовать «вакуум» шприца: после прокола кожи и сосуда к игле присоединяем шприц (со стабилизатором или без) и набираем кровь. Стоит помнить, что форсированное насасывание крови в шприц может привести к частичному разрушению (гемолизу) клеток крови, что отразится на корректности результатов. И все же мы рекомендуем практиковать именно этот способ отбора крови.
Техника отбора крови из хвостовой вены:
- Животное фиксируют в станке.
- Очищают область у корня хвоста.
- Иглу берут в одну руку, второй рукой удерживают хвост и поднимают его так, чтобы визуально можно было контролировать место введения иглы.
- Игла вводится на глубину примерно 1 см перпендикулярно нижней поверхности хвоста, по центру. Лучше прокол делать на расстоянии 8-12 см от основания хвоста. Можно использовать ориентир «ширина кисти»: от основания хвоста отступить 1,0-1,5 ширины кисти. В этой области хвостовая вена имеет наибольший диаметр (около 0,5-0,8 см) и вероятность попасть в нее максимальна.
Молочные вены определяются как тяжи на нижнебоковой поверхности живота с двух сторон, идущие от вымени вперед. Они очень хорошо видны и доступны, что создает псевдо-эффект банальности процедуры. На самом деле при проколе молочных вен самая главная проблема – безопасность! Во-первых, действия происходят вблизи тазовых конечностей. Во-вторых, кожа, покрывающая сосуд, достаточно толстая, поэтому необходимо точно рассчитать силу удара при проколе. Автор получал травмы рук при таком взятии крови у коровы.
Взятие крови у свиней
Лучшее место для процедуры – сосуды ушных раковин, кончик хвоста, глазной синус, передняя полая вена.
Многие специалисты отсекают кончик хвоста, что ведет к гемолизу. При этом стерильность пробы оставляет желать лучшего. Картина ухудшается кровотечением и возникающим каннибализмом.
Эффективнее брать материал из передней полой вены, но для этого нужен определенный опыт. К тому же, такой способ является трудоемким.
Удобнее материал брать из глазного синуса. Стратегия взятия биопробы:
- Фиксируют свинью за верхнюю челюсть с помощью петли. Поросят допускается фиксировать в спинном положении, дополнительно ограничить подвижность головы рукой.
- Кровь берется при помощи вакуумного шприца. Допускается использовать обыкновенную иглу и пробирку.
- Иглу вводится во внутренний угол глаза под третье веко, скосом к кости (не к глазному яблоку!). При этом манипулируют канюлей так, чтобы оттеснить глазное яблоко иглой (условно ориентируясь острием на противоположный локтевой бугор).
С опытом легко определяется необходимая глубина введения иглы: 2-3 см – у взрослых свиней, 0,5-1,0 см – у поросят. Начинающим ветврачам можно иглу вводить до ощущения упора в кость.
- Если все сделано правильно, то при отводе иглы от кости кровь должна начать течь сама. Как правило, на пробирка объемом 20 мл наполняется за полторы минуты (быстрее при визге животного).
- Капающая кровь из места прокола убираются тампоном.
Тип крови
Перед процедурой надо знать, какая кровь нужна для исследования: стабилизированная («несвернутая») или нестабилизированная (свернутая).
Стабилизированную кровь предохраняют от свертывания, добавляя в нее антикоагулянт. Такая кровь, как правило, используется для общего клинического анализа (определения количества эритроцитов, лейкоцитов, тромбоцитов, гемоглобина, гематокрита, СОЭ, цветового показателя).
Применяемые на практике антикоагулянты представлены различными солями и биологическими веществами:
- калия или натрия оксалаты;
- натрий лимоннокислый;
- трилон Б;
- гепарин. Запрещен при ПЦР-диагностике.
Чтобы стабилизировать кровь у пернатого, удваивается доза антикоагулянта.
Кровь – жидкая ткань организма, выполняющая ряд функций, одной из которых является транспортная. Осуществляя в организме транспорт химических веществ, происходит интеграция биохимических процессов в различных клетках и межклеточных пространствах в единую систему. Правильно отобранные образцы крови предоставляют возможность мониторинга нозологического профиля поголовья, уровня метаболических процессов, обеспеченности организма витаминами, минералами, незаменимыми аминокислотами и т.д. Для получения достоверных результатов необходимо свести к минимуму возможность появления артефактов, обусловленного нарушением правил отбора проб крови, ее стабилизирования и транспортировки.
Иглы перед взятием крови от каждого животного обязательно стерилизуют кипячением, либо применяют стерильные. Оптимальным вариантом является использование шприц-пробирок или вакуумных пробирок. При их использовании кровь не контактирует с внешней средой, т.е. остается асептической и не подвергается окислению кислородом воздуха, тем самым предупреждается агрегация тромбоцитов и образование сгустков в образцах, предназначенных для полного определения клеточного состава крови. Место пункции необходимо обработать 70%-ным спиртовым раствором или 3%-ным раствором карболовой кислоты. При заборе крови нужно следить, чтобы она стекала по стенке в пробирку струей, а не каплями. Кровь, взятая каплями и вспененная, быстрее гемолизируется и часто дает неправильные результаты показаний при лабораторных исследованиях.
Таблица 1. Влияние гемолиза на результаты исследований биохимических компонентов сыворотки крови

Существует несколько способов отбора проб крови у свиней. Среди них можно выделить:
- Из ушной вены и вены хвоста
Данный способ подходит, если необходимо отобрать небольшое количество крови (2-3 мл). Для асептического отбора используется шприц с иглой толщиной 0,8 мм (типа Луер), и отбор крови осуществляется при внутривенном введении иглы, в противном случае происходит бакобсемененность образца. Вены уха свиньи, как правило, расположены в трех точках уха и легко различимы. Одна вена располагается вдоль внешнего края уха, другая – посередине, третья – около 2 см от медиального края. Хвостовые вены находятся в вентральной части хвоста. Для этого способа взятия крови требуются иглы 0,8х25 мм.
После отбора крови необходимо удалить иглу, а место пункции пережать лещеткой, лигатурой или большим пальцем руки на 2-3 минуты. Опасность метода состоит в том, что лигатура может произвольно соскочить и произойдет обескровливание организма животного.
Это безопасный и быстрый способ отбора крови, требующий правильной фиксации животного. Для этого используют металлическую петлю или веревку, при помощи которых животное фиксируется в стоячем положении. При фиксации голова поросенка должна быть поднята вверх таким образом, чтобы шея образовала прямую линию, а кожа была натянута.
Отбор крови производят с правой стороны (при дыхательной недостаточности, развивающейся у свиней при пневмонии или плевропневмонии возможно при введении иглы повреждение левого диафрагмального или блуждающего нерва, поэтому рекомендуется введение иглы справа). Точка пункции находится на краю плечеголовной мышцы – внешнего края яремного желоба, на линии между краем плечевого сустава и рукояти грудной кости (рис 1, 2). Вторая линия проходит от рукояти грудной кости к основанию уха. Глубина прокола для взрослых животных составляет от 75 до 100 мм, для маленьких поросят – 40-75 мм.

Рис. 1. Поверхностные мышцы шеи свиньи
Рис. 1.1. Сеть венозных сосудов шеи
Рис. 2. Место пункции яремной вены
Рис. 3. Забор крови из яремной вены
После введения иглы под кожу поршень шприц-пробирки необходимо отвести назад для создания в ней отрицательного давления. Игла вводится в дорсомедиакаудальном направлении (рис. 3). Когда кровь начинает поступать в пробирку, необходимо следить, чтобы она не вспенивалась, не капала, не билась о дно, а плавно стекала по стенке – с целью предупреждения гемолиза эритроцитов.
Если игла с первого раза не попала в яремную вену, ее необходимо отвести назад и вводить в слегка измененном произвольном направлении. Если и в этот раз цель не достигается, иглу необходимо заменить. При наличии кровотечения после извлечения иглы, место пункции необходимо прижать большим пальцем руки до ее полной остановки.
- Из краниальной полой вены
Свиней массой о С, исключая воздействие света и тепла. Если сыворотка будет исследована позже, в течение недели или на следующей неделе, ее необходимо заморозить при -20 о С и исследовать сразу же после разморозки.
Таким образом, если целью отбора крови является получение достоверных результатов, необходимо четко следовать методическим требованиям при отборе, хранении и транспортировке проб. В современных условиях (насыщенности ветеринарной программы, удаленности лаборатории от производства, отсутствия необходимого инвентаря и оборудования) этого сделать практически невозможно. Поэтому при интерпретации полученных из лаборатории результатов, необходимо учитывать все факторы, которые могут на них повлиять. Четкой границы, дифференцирующей патологию от физиологической нормы, у свиней не существует. На полученные из лаборатории результаты можно ориентироваться, но 100% им доверять нельзя.
Читайте также:

