Анурия у кота симптомы лечение
Опубликовано: 28.04.2024
Рене Дёрфельт, дипл. ECVM
Университет Людвига и Максимилиана, Мюнхен, Германия
Доктор Дёрфельт обучался в Лейпцигском университете, Германия, и окончил его в 2003 году. После защиты диссертации по гемодиализу и интернатуре в небольшой ветеринарной клинике в Свободном университете Берлина он в 2005-2007 годах поработал в ветеринарной клинике города Нордерштедта в Германии, а затем прошел ординатуру по анестезии и обезболиванию в Университете ветеринарной медицины Вены. С 2011 года он возглавляет Службу неотложной помощи и реанимации в небольшой ветеринарной клинике при Университете Людвига и Максимилиана в Германии.
Уменьшение или отсутствие отделения мочи (соответственно, олигурия и анурия) — это всегда острые опасные для жизни ситуации, которые могут свидетельствовать о других нарушениях или развиваться на их фоне. Олигурия определяется как выработка 1,030, а у кошек > 1,035. При почечных причинах анурии USG, как правило, находится в изостенурическом диапазоне (1,008-1,012). При сочетании пре- и ренальных поражений, или если была начата терапия, дифференциацию проводить трудно. Постренапьные причины следует определить при последующем обследовании.
При острых почечных процессах при пальпации почек часто отмечается боль. При постренапьных поражениях почки или мочевой пузырь часто болезненны и/или растянуты. При попадании мочи в брюшную полость, если количество свободной жидкости > 40 мл/кг, можно выявить асцитическое дрожание (1).
При анурии особенно опасны для жизни метаболический ацидоз, гиперкалиемия, анемия. Необходимо провести анализ газового состава крови, а также определить уровни электролитов и гематокрит (Hct).
Гиповолемия
Поскольку преренальные причины способствуют прогрессированию прямого гипоксического поражения почек и острого повреждения почек, неотложная терапия в этих случаях включает лечение шока и, где это применимо, обезвоживания. В дополнение к даче кислорода пациентам в состоянии шока вводят кристаллоидные растворы внутривенно струйно (
10-20 мл/кг в течение 10 минут), повторяя вливание до восстановления параметров перфузии. Коллоидные инфузионные растворы позволяют увеличивать объем циркулирующей крови в среднесрочной перспективе, причем все чаще используют растворы со средней молекулярной массой, такие какгидроксиэтилкрахмал (HAES). Рекомендуемую дозу определяют по тяжести шока и вводят внутривенно струйно со скоростью 5-10 мл/кг в течение 10 минут. Обратите внимание, что высокомолекулярные растворы HAES могут вызывать развитие острой почечной недостаточности; для растворов со средним молекулярным весом это менее вероятно.
Таблица 1. Лечение гиперкалиемии.
| Плазменный уровень калия | Терапия | Механизм и примечания |
| 5,5-6,0 ммоль/л | Вливание растворов, не содержащих калия | Разведение + возможно, диурез |
| 6,0-6,5 ммоль/л | Дополнительно: • Фуросемид 2,0-4,0 мг/кг в/в • Гидрохлоротиазид 2,0-4,0 мг/кг в/в | Диуретическое действие калия происходит в петле Генле и/или дистальных канальцах |
| 6,5-7,0 ммоль/л | Дополнительно: • Инсулин 0,1-0,25 МЕ/кг в/м + 1-2 г глюкозы в/в на каждую единицу инсулина • Бикарбонат натрия 8,4% по 1,0-2,0 ммоль/ кг внутривенно в течение 10-15 мин | Переносит калий в клетку; требуется регулярный контроль уровня глюкозы в крови Переносит калий в клетку путем повышения pH; требуется регулярный контроль уровня pH в крови |
| Кроме того, при наличии изменений на ЭКГ можно ввести 10% глюконат кальция по 0,5-1,0 мл/кг внутривенно в течение 10 минут, с одновременным мониторированием ЭКГ. | ||
Если на фоне введения более высоких объемов жидкости (
90 мл/кг) основные физиологические показатели существенно не улучшатся, можно подозревать наличие сопутствующих нарушений (например, сепсиса), поэтому, когда это применимо, следует ввести инотропные препараты или вазопрессоры. Если развилось обезвоживание (как правило, вследствие рвоты или анорексии), его выраженность оценивают по степени увлажнения слизистых и эластичности кожи и, в зависимости от скорости его развития, купируют в течение 4-24 часов с использованием кристаллоидных инфузионных растворов.
Гиперкалиемия часто может сопровождать острое повреждение почек. Сывороточные уровни калия >7-8 ммоль/л могут вызывать сердечные аритмии, брадикардию и даже остановку сердца. Лечение гиперкалиемии подбирают в зависимости от ее тяжести (табл. 1). На начальном этапе следует попытаться снизить уровень калия использованием инфузионных растворов, не содержащих калия. Если концентрация калия составляет 6-7 ммоль/л, также следует ввести мочегонные средства, способствующие выведению калия с мочой (например, фуросемид или гидрохлоротиазид) (2). Для переноса калия внутрь клетки можно вместе с глюкозой внутривенно ввести инсулин короткого действия, чтобы предотвратить гипогликемию. Чтобы увеличить pH крови и скорость переноса калия в клетки, можно ввести бикарбонат, но, если содержание углекислого газа в выдыхаемом воздухе в конце выдоха остается высоким или имеется алкалоз, введение бикарбоната противопоказано. Если на ЭКГ выявлены брадикардия, отсутствие зубцов Р, расширение комплекса QRS или высокий остроконечный зубец Т—обусловленные гиперкалиемией, — вводят глюконат кальция, одновременно мониторируя ЭКГ. Особенно тяжелую гиперкалиемию можно уменьшить с помощью гемодиализа или перитонеального диализа.
Ацидоз
с уремией температура тела нормальная, следует рассмотреть инфекционные или опухолевые причины.
Анализ мочи
Основным компонентом диагноза являют данные анализа мочи. Признаком нарушения в проксимальных канальцах служит глюкозурия, если уровень глюкозы в крови 160 мм рт. ст. рекомендуется провести ее терапию (например, амлодипином по 0,25-0,5 мг/кг), при условии строгого контроля артериального давления и параметров почечной функции.
Уремические токсины, вырабатываемые при ОПП (особенно инфекционные), могут снизить сердечный выброс и уменьшить сократительную способность миокарда. Это может привести к развитию гипотонии и аритмий, например, желудочковых экстрасистол. Кроме того, часто развивается увеличение тонуса блуждающего нерва (и, следовательно, брадикардия). Если выявлена желудочковая экстрасистолия, целесообразна терапия лидокаином. На фоне рвоты повышение тонуса блуждающего нерва может привести к синдрому «рвота и гибель»; для его профилактики, если отмечается брадикардия, можно ввести гликопирролат.
Желудочно-кишечные осложнения
У животных с ОПП часто развивается анорексия, связанная как с действием уремических токсинов, так и с язвами в полости рта и желудочно-кишечном тракте. Развитию тошноты и анорексии дополнительно способствуют уменьшение потребления корма и опорожнение желудка. При этом нарушаются обмен веществ, иммунитет и процессы заживления ран. Целесообразно назначить противорвотные, прокинетики и гастропротекторы (табл. 2). Раннее энтеральное питание имеет важное значение и помогает облегчить склонность к катаболическому состоянию, и для его стимуляции можно назначать корм высокой вкусовой привлекательности (в идеале — представленную на рынке диету для животных с заболеваниями почек) и стимуляторы аппетита, а также проводить зондовое кормление. Если рвота продолжается, также следует назначить центральное парентеральное питание. У животных с язвами в полости рта ее можно очищать несколько раз в день хлоргексидином, а в области язвы проводить местную анестезию. Для системного обезболивания целесообразно назначить опиоиды (струйно или в виде вливания с постоянной скоростью).
Анемия
Все случаи анемии следует лечить переливанием крови, пока не будет достигнута регенерация. При некупируемой анемии также можно назначить эритропоэтин в дозе 100 МЕ/кг каждые 2-3 дня. Может произойти образование антител, в частности, к рекомбинантному человеческому эритропоэтину, но при использовании более длительно действующего дарбэпоэтина альфа интервал дозирования можно увеличить и, следовательно, уменьшить выработку антител (19).
Центральная нервная система
Высокий уровень уремических токсинов может привести к развитию уремической энцефалопатии. Судороги можно лечить с помощью мидазолама (по 0,2-1 мг/кг струйно, или по 0,05-0,2 мг/кг/ч в качестве вливания с постоянной скоростью). Если судороги сохраняются, также можно использовать пропофол или альфаксалон. Кроме того, следует попытаться снизить нагрузку токсином, проведя гемо- или перитонеальный диализ.
Легкие
Повреждение легких может быть обусловлено самой по себе уремией, гипергидратацией, аспирацией или основным заболеванием. Уремические токсины вызывают химическое раздражение легких и развитие уремической пневмонии; последняя может привести к развитию острого респираторного дистресс-синдрома. Острое легочное кровотечение (которое все чаще описывают на фоне лептоспироза, хотя его причина
до сих пор не выяснена) может привести к развитию дыхательной недостаточности и смерти. Как правило, единственным вариантом терапии оказывается терапия кислородом; если ее недостаточно, может потребоваться искусственная вентиляция легких.
Диализ
Для симптоматического лечения уремии с одновременным снижением уровня уремических токсинов рекомендуется обеспечить коррекцию кислотно-щелочного и электролитного баланса, а также обмена жидкости с помощью гемо- или перитонеального диализа. После установки катетера в брюшной полости можно легко проводить перитонеальный диализ, хотя он более трудоемок и только умеренно эффективен; гемодиализ предпочтительнее, но на проведении гемодиализа животным специализируются всего несколько центров. Показания к диализу включают ОПП, не купируемые обычной терапией в течение 12-24 часов, сывороточные концентрации креатинина > 500 мкмоль/л (5,7 мг/ дл), интоксикации, рефрактерную гиперкальциемию.
Этиотропная терапия
Если причина почечной недостаточности известна, следует провести ее специфичное лечение. При лептоспирозе назначают амоксициллин, ампициллин или другие производные пенициллина. При инфекциях мочевыводящих путей антибиотики следует выбирать на основе данных цитологического анализа мочи, в то же время ожидая результатов антибиотикограммы. Если выявлены кокки, я предпочитаю амоксициллин/кпавулановую кислоту (по 20 мг/кг каждые 8 ч в/в), если палочки—то я предпочитаю марбофлоксацин (по 4 мг/кг каждые 24 ч).
При интоксикации этиленгликолем эффективное лечение в течение 8 часов после его приема позволяет предотвратить развитие почечной недостаточности (20). Следует уменьшить преобразование этиленгликоля в щавелевую кислоту апкогольдегидрогеназой и увеличить выведение этиленгликоля. Фермент можно ингибировать с помощью 4-метилпиразола (Fomepizole) или, если он недоступен, этанола в виде вливания с постоянной скоростью (21). Для содействия выведению этанола можно обеспечить форсированный диурез с помощью сбалансированного раствора электролитов (по крайней мере по 6 мл/кг внутривенно) и фуросемида (струйно или в виде вливания с постоянной скоростью).
Заключение
Животным с острым повреждением почек всегда следует проводить интенсивную терапию. Необходимо обеспечить адекватный круглосуточный мониторинг. При стандартном наблюдении проводят клиническое обследование и оценку основных физиологических показателей и выделения мочи каждые 4 часа, определяя артериальное давление для выявления гипо- или гипертонии каждые 4-12 часов. Мы внимательно следим за уровнями электролитов, глюкозы, показателями почечной функции, гематокритом и уровнем альбумина, а также ежедневно взвешиваем животное и измеряем центральное венозное давление. Все эти меры необходимы для подбора оптимального лечения и максимального повышения шансов на выздоровление.
Что такое острая почечная недостаточность и почему она возникает
Острая почечная недостаточность (ОПН) – это тяжелое патологическое состояние, которое заключается в нарушении выделительной функции почек. Этот процесс имеет быстрое развитие, как правило, обратим, и сопровождается резкими изменениями кислотно-щелочного, водного и электролитного баланса, уменьшением выведения почками различных веществ из организма и, как следствие, их накоплением.
Причиной таких изменений являются резкое снижение кровотока в почках, поражения ткани почек и/или нарушения оттока мочи из почек. Другими словами, острая почечная недостаточность бывает:
- Преренальная («допочечная») – развивается при резком падении артериального давления и нарушении внутрипочечной циркуляции крови, вследствие шока различного происхождения (кровотечение, отравление, инфекции, тепловой удар), обезвоживания (например при панлейкопении), сердечной недостаточности.
- Ренальная («почечная») – развивается при бактериальных инфекциях почек (пиелонефрите), воспалительных заболеваниях почек (остром гломерулонефрите, интерстициальном нефрите) и общесистемных инфекционных заболеваниях (вирусный иммуннодефицит). Причиной развития ОПН может стать воздействие на тканевые структуры почек различных токсических веществ (этиленгликоль, соли тяжелых металлов, анилин), лекарственных препаратов (аминогликозидов, химиотерапевтических препаратов, рентгеноконтрастных веществ, нестероидных противовоспалительных средств и некоторых других препаратов), змеиного яда. К ренальной почечной недостаточности может привести закупорка почечных канальцев гемоглобином разрушенных эритроцитов при массивном их гемолизе, например, при гемобартонеллёзе или в результате заболеваний, сопровождающихся развитием ДВС-синдрома (отравление гемолитическим ядом, тяжелые формы сепсиса).
- Постренальная («послепочечная») – развивается при закупорке или сдавливании мочевыводящих путей (мочеточников, мочевого пузыря или мочеиспускательного канала), например, опухолью. Наиболее частой причиной острой почечной недостаточности у котов является мочекаменная болезнь.
Кроме выделительной, почки выполняют ряд других функций в организме – регулируют состав крови и других жидкостей тела, участвуют в водно-солевом обмене, обмене белков и углеводов, синтезируют биологически-активные вещества, регулирующие уровень артериального давления и процесс кроветворения. Поэтому почечная недостаточность (в особенности, хроническая) приводит к дополнительным нарушениям, таким как падение уровня гемоглобина, нарушениям гормонозависимых функций и кальциевого обмена.
Нарушения жидкостного и электролитного баланса, а также накопление продуктов обмена в крови дает начало осложнениям со стороны сердечно-сосудистой и нервной систем, приводит к желудочно-кишечным расстройствам и кровотечениям, а так же к подавлению иммунитета.
Как проявляется острая почечная недостаточность
Клинические признаки ОПН носят неспецифический характер: общее угнетение, изменение объема мочи (уменьшение объёма мочи, вплоть до полного прекращения мочеотделения), слабость, рвота, диарея, снижение аппетита или его отсутствие, увеличение частоты пульса, отеки, бледность или покраснение слизистых. Тяжесть клинических проявлений может варьировать от незначительных нарушений, незаметных для владельца, до самых тяжёлых расстройств.
При обнаружении любых подобных симптомов следует немедленно доставить животное в клинику.
У каких пациентов наиболее часто бывает острая почечная недостаточность
К группе повышенного риска относятся пациенты, страдающие от болезней почек, тяжелой травмы или системного заболевания (панкреатит, сахарный диабет, сердечно-сосудистые заболевания, болезни печени). К дополнительным факторам риска относятся обезвоживание, нарушения электролитного баланса, пониженное или повышенное артериальное давление, лихорадка, сепсис.
Как врач ставит диагноз «острая почечная недостаточность»
Диагноз ОПН ставится на основании сведений, сообщаемых владельцем животного (анамнеза), осмотра, а самое главное, результатов лабораторных анализов. Важным симптомом является уменьшение количества выделяемой животным мочи (олигурия) или её полное отсутствие (анурия). При осмотре могут обнаруживаться все или некоторые из следующих признаков: запах мочи в выдыхаемом воздухе, бледность слизистых, слабость, признаки обезвоживания, пониженная температура. Почки могут быть увеличены в размере и болезненны. По данным лабораторных анализов наблюдается быстрое развитие азотемии, то есть увеличение содержания в крови мочевины и креатинина (они являются основными показателями работы почек). Кроме этого, обычно повышается уровень фосфора и кислотность крови. В анализе мочи выявляют наличие белка и глюкозы, а также цилиндров и клеток почечного эпителия в осадке, возможно так же появление кристаллов солей и эритроцитов. Кроме этого, применяют рентген-диагностику, в том числе с введением специальных веществ в кровь (например, для исключения камней в почках, определения их размеров, уровня кровоснабжения почек и других патологий), УЗИ-диагностику и в некоторых случаях биопсию почек.
Лечение
Лечение пациентов с острой почечной недостаточностью должно быть комплексным и направлено на устранение причины, стимуляцию диуреза, коррекцию жидкостного и электролитного дисбаланса, кислотно-щелочных нарушений, выведение из организма накопившихся в нём токсинов, и устранение системных осложнений. Данным пациентам требуется проведение интенсивной терапии в условиях стационарного отделения клиники.
В первую очередь врачи стараются устранить причину, вызвавшую развитие острой почечной недостаточности, что может само собой способствовать восстановлению диуреза. При установленной постренальной почечной недостаточности необходимо как можно скорее обеспечить свободный отток мочи (введение мочевого катетера, откачивание мочи шприцом через брюшную стенку, или с помощью хирургической операции). Параллельно, принимаются меры для восстановления адекватного процесса образования и выделения мочи (назначаются препараты, улучшающие внутрипочечный кровоток, микроциркуляцию в тканях почек, мочегонные препараты, которые вводятся внутривенно, строго дозировано с помощью внутривенных дозаторов под постоянным контролем лечащего врача).
Для коррекции водно-электролитного баланса, кислотно-щелочных нарушений необходима инфузионная терапия. Выбор лечебной тактики зависит от характера основного и сопутствующих заболеваний, степени поражения почек и общего состояния больного. Инфузионную терапию обычно продолжают до тех пор, пока содержание мочевины и креатинина не достигнет нормального уровня, наладится адекватный диурез и стабилизируется общее состояние пациента.
В период лечения необходимо постоянно контролировать жизненно важные функции организма больного животного: оценивать его клиническое состояние, объем выделенной мочи в час, показатели мочевины и креатинина, электролиты и газы крови, показатели красной крови – гематокрит, гемоглобин, количество эритроцитов, цветовой показатель крови (для контроля за развитием анемии), а также другие лабораторные показатели.
Осложнением почечной недостаточности, может быть повышение содержания ионов калия в крови, которое может привести к мышечной слабости и нарушениям сердечного ритма. Частым осложнением почечной недостаточности является рвота. Ее причиной может быть действие токсинов на центральную нервную систему и/или язвенная болезнь желудочно-кишечного тракта. Для профилактики этого осложнения используют препараты, защищающие слизистую желудочно-кишечного тракта, и противорвотные препараты.
В случае развития необратимых патологических изменений в почечной ткани, когда функция почек восстанавливается не в полном объеме, острая почечная недостаточность переходит в хроническую стадию, которая постепенно развивается и характеризуется прогрессирующим необратимым повреждением почечной паренхимы. Терминальной стадией хронической почечной недостаточности является острая почечная недостаточность, но при этом она носит необратимый характер и прогноз в данном случае неблагоприятный.
Для пациентов с тяжелыми, неустранимыми электролитными и другими нарушениями, а так же для пациентов в терминальной стадии хронической почечной недостаточности, показано проведение перитонеального диализа. Эта процедура проводится только в условиях клиники. Для проведения диализа животному в брюшную полость под общим наркозом устанавливают дренажи, через которые вводят специальную жидкость и оставляют её в брюшной полости на определенное время. За этот период в эту жидкость из организма переходят вредные вещества, а также происходит обмен электролитами и водой. Затем жидкость из брюшной полости удаляют. Процесс периодически повторяют.
Несмотря на своевременную врачебную помощь и адекватное лечение пациенты нередко погибают от острой почечной недостаточности, по причине развития необратимых, несовместимых с жизнью нарушений в работе организма.
Питание
Животные с почечной недостаточностью должны получать питательные вещества. Если животное питается самостоятельно, то всё, что необходимо, это кормить его специальными лечебными диетическими кормами. Диета при почечной недостаточности характеризуется пониженным содержанием белка, фосфора и натрия в рационе кошки.
Если аппетит отсутствует, но рвоты нет, то прибегают к кормлению через зонд. Если присутствует рвота, то используют парентеральное питание (внутривенное введение растворов аминокислот, липидов и глюкозы).
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
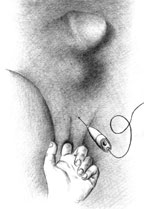 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
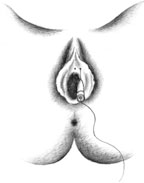 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва

уролог / Стаж: 29 лет
Дата публикации: 2020-10-14
уролог / Стаж: 28 лет
Мочеиспускание – произвольный процесс. Он контролируется центральной нервной системой и происходит только по воле человека. В норме мочеотделение происходит легко и свободно, без затруднений, болезненных ощущений, после чего человек чувствует полное опорожнение мочевого пузыря.
Любые нарушения этой физиологической процедуры должны настораживать: дискомфорт при посещении туалета может свидетельствовать о серьезных нарушениях функций мочевыделительной системы.
Женская мочеполовая система отличается от мужской только строением мочеиспускательного канала – уретры, который у женщин составляет всего 4 см. Это определяет особенности гендерной зависимости заболеваний мочеполовой системы: инфицирование женского организма через уретру происходит гораздо быстрее, чем мужского. Поэтому важно как можно раньше обратить внимание на тревожные симптомы и вовремя начать лечение. Это поможет предотвратить серьезные и даже опасные осложнения.
Как определить признаки затрудненного мочеиспускания?
Затрудненное мочеиспускание – это один из распространенных признаков патологий мочевыделительной системы. Несмотря на то, что этот симптом чаще встречается у мужчин, женщины также должны быть насторожены при признаках затруднения мочевыделительных процессов.
С медицинской точки зрения это нарушение входит в понятие «дизурия». Дизурический синдром объединяет в себе любые расстройства мочеиспускания. Как правило, такая клиническая картина свидетельствует о заболеваниях нижних отделов мочевыводящей системы, однако инфекция у женщин распространяется с такой скоростью, что несколько дней могут стать решающими, а простое воспаление – перерасти в серьезное инфекционное заболевание.
Если есть подозрения на проблемы с выделением мочи, можно сравнить свою ситуацию с нормальными показателями работы мочевыделительных органов.
Доказано, что в сутки здоровый организм через почки в среднем выводит около 75 % принятой жидкости, то есть у человека выделяется примерно 1,5 литра суточной мочи (норма – употребление 2 литров жидкости в день).
Частота мочеиспусканий в течение дня для женщин составляет от 4 до 9 раз в сутки, а в ночное время должно быть не больше одного похода в туалет. Если в течение дня количество посещений дамской комнаты резко уменьшается, возникают трудности при мочеиспускании, а после этого процесса остается ощущение наполненного мочевого пузыря, нужно обратиться к специалисту для решения таких проблем.
Самое время обратиться к врачу, если наблюдается:
- ослабление силы струи во время мочеиспускания;
- ощущение вялости или истончения струи;
- выделение мочи каплями;
- болезненность во время мочевыделения;
- необходимость постоянного натуживания при выделении мочи;
- ощущение неполного опорожнения мочевого пузыря.
Причины затрудненного мочеиспускания у женщин
Затруднение мочеиспускание может быть острым и хроническим. Также его вариации различаются по механизму развития. Поэтому причины заболевания целесообразно разбирать в связке с вариантами затрудненного опорожнения мочевого пузыря.
Ишурия
Одна из наиболее опасных ситуаций – это невозможность опорожнить полный мочевой пузырь, которая чаще всего развивается как вторичное проявление других патологий. Несмотря на то, что ишурия может быть в хроническом варианте, это достаточно серьезное состояние, которое может обернуться фатальными последствиями. Во всем мире именно ишурия занимает лидирующие позиции среди всех поводов оказания неотложной медицинской помощи.
Ишурия сопровождается ощущением переполненного мочевого пузыря, однако при этом акт мочеиспускания не происходит.
Наиболее частыми причинами ишурии считаются:
Чтобы говорить о хронической ишурии, объем остаточной мочи должен превышать 300 мл. Такая ситуация должна длиться более полугода. В подобных случаях необходимо искать причину заболевания, например, непроходимость мочевыводящих путей, неправильную работу почек или нарушение нервной регулировки процесса мочевыделения.
У женщин без сопутствующих заболеваний чаще всего ишурия развивается постепенно. К ней приводят воспаления органов мочеполового тракта.
Чаще других патологий воспалительного характера женщин беспокоят циститы. Легкий путь распространения инфекции из наружных половых органов становится фактором риска воспаления мочевого пузыря. Это заболевание не опасно при своевременном обращении к врачу и соблюдении принципов лечения.
Странгурия
Частичное затруднение оттока мочи, которое характеризуется частым, но скудным и нередко болезненным мочеиспусканием, называется «странгурия». В этом случае моча выходит только после натуживания. Помочиться полноценно не получается, даже несмотря на сильное чувство позывов. Часто натуживания сопровождаются болезненными спазмами, боль может распространяться на органы таза, поясницу, мышцы брюшного пресса. Патологическое состояние чаще всего возникает в случае наличия препятствия для оттока мочи – давления опухоли или локального сужения уретры. Также к странгурии могут приводить поражения нервной системы – нервных структур, которые отвечают за нормальную работу мочеполового тракта.
Наиболее частыми причинами странгурии у женщин становятся:
- онкологические заболевания мочеиспускательного канала;
- мочекаменная болезнь, которая проявляется в виде камней в уретре;
- сужение внутреннего просвета мочевыводящих путей кистой или инородным телом;
- опухоли шейки или стенок мочевого пузыря.
У пациенток в почтенном возрасте существует еще одна проблема – ослабление мышц тазового дна, за счет чего происходит выпадение половых органов. Это может приводить к ряду неприятных проблем, в том числе – механической закупорке мочевыводящих путей.
Анурия
Затрудненное мочеиспускание может быть связано с нарушениями почечных отделов мочевыводящей системы. Если в мочевом пузыре нет урины, то позывы автоматически не возникают, а количество походов в уборную резко сокращается. Это состояние называется анурией. Она может возникать как следствие:
- мочекаменной болезни;
- хронического пиелонефрита или гломерулонефрита;
- туберкулезного поражения почек;
- почечного амилоидоза и других болезней накопления;
- тяжелых декомпенсированных сердечно-сосудистых заболеваний.
Нейрогенная дисфункция
Еще одна группа причин нарушения мочевыделительной функции – это повреждения нервной системы на уровне головного или спинного мозга или периферических нервных структур. Причинами нейрогенных нарушений могут быть различные патологии развития нервной системы, опухоли, осложнения после операций или других болезней. К затруднению мочеиспускания обычно приводит гипорефлекторная деятельность.
В такой ситуации позыв к мочеиспусканию возникает реже, чем должен быть в норме. В результате мочевой пузырь переполняется, его своевременного опорожнения не происходит: моча выделяется медленно, редко, в виде тонкой струи или капель.
Прерывистое мочеиспускание
Еще один вариант затрудненного мочеиспускания – его прерывистость: периодическое нарушение тока мочи в процессе ее выделения. Это может возникать при формировании камня или инородного тела в любом из отделов мочеполовой системы, а также при неконтролируемом периодическом спазме уретры.
Другие причины затрудненного мочеиспускания у женщин
Кроме распространенных заболеваний мочеполовой системы, есть ряд болезней, которые могут проявляться рядом проблем при мочевыделении. К ним относятся:
- подагра – при заболевании накапливаются соли мочевой кислоты, часто поражается почечный аппарат;
- осложнения воспалительных процессов любой локализации – распространение инфекции внутри организма может приводить к вторичным воспалениям органов мочеполовой системы;
- болезни накопления – обменные нарушения приводят к изменениям нормальной работы мочевыделительного аппарата;
- сахарный диабет – диабетическая нефропатия часто сопровождает заболевание и приводит к развитию ряда неприятных симптомов, в том числе, нарушениям опорожнения мочевого пузыря;
- психосоматические проявления – в некоторых случаях проблемы мочеполовой системы связаны с сильными стрессовыми воздействиями.
Чем опасно затрудненное мочеиспускание?
Начальные этапы нарушений мочевыделительной функции обычно не опасны для человека: организм старается компенсировать патологическое мочеиспускание. Однако через время проблема прогрессирует, объем остаточной мочи постоянно растет. Это вызывает дискомфорт, может приводить к компенсаторному недержанию мочи и развитию инфекций. Также опасен переход странгурии в острую задержку мочеиспускания.
Куда обращаться при проблемах с мочеиспусканием?
Существует миф, что абсолютно все проблемы, связанные с нарушением мочеиспускания, – это поле деятельности урологов. На самом деле, часто проблема скрывается не в самой мочевыделительной системе (или наоборот представляет собой серьезное заболевание, которое лечат врачи нескольких специальностей).
При первичном возникновении характерных жалоб необходимо обратиться к семейному врачу или терапевту. Специалист широкого профиля определит специфику проблемы и сможет назначить лечение самостоятельно или направить к нужному узкому врачу.
Причины затрудненного мочеиспускания обычно определяют во время приема уролога или нефролога. Также для выявления смежных нарушений работы мочеполовой системы у женщин могут «подключаться» гинекологи и неврологи. Если ситуация становится серьезной, периодические жалобы на затруднение мочеиспускания переходят в ситуацию, когда самостоятельное выделение мочи невозможно, нужно вызвать скорую помощь. Врачи неотложных состояний установят мочевой катетер и предложат место для последующей госпитализации. Только в стационаре можно достоверно установить причину острой задержки мочи и успешно ее устранить.
Диагностические мероприятия
Чтобы правильно поставить диагноз, врачам необходимо тщательно собрать все жалобы: определить особенности нарушения мочевыделительной функции, частоту возникновения и степень выраженности симптомов. Также специалист будет выяснять анамнез заболевания. Ему важно знать, когда впервые появились жалобы, что могло стать причиной развития патологии, есть ли связь между изменениями работы мочеполовой системы и другими болезнями.
Объективное обследование у женщин включает в себя осмотр поясничной области и органов таза, наружных половых органов, в том числе, у гинеколога. Во время обследования врач оценивает симптом Пастернацкого – поколачивания по пояснице в зоне проекции почек для определения почечных заболеваний.
У пациенток обязательно берут мазок из уретры на предмет воспалительных заболеваний нижних отделов мочевыводящих путей. Кроме того, назначают стандартные клинические анализы крови и мочи, дополнительные исследования для оценки почечных функций и содержания патогенной микрофлоры. К таким анализам относится определение количества суточной мочи, пробы для оценки состава урины, бактериологический посев с выявлением чувствительности болезнетворных микроорганизмов к разным антибиотикам.
Из инструментальных методов диагностики важную роль играет УЗИ почек и органов малого таза, а также более детальная визуализация проблемных участков мочеполовой системы – КТ и МРТ.
При необходимости проводится психотерапевтическое консультирование: некоторые нарушения мочеполовой системы могут быть следствием психологических проблем.
Лечение
Чтобы нормализовать функцию мочеиспускания, в первую очередь нужно определить, почему возникают такие нарушения. При острой задержке мочи обязательна катетеризация уретры, которая может быть временной или постоянной.
Если нарушения вызваны инфекционно-воспалительными процессами, назначаются антибиотики и противовоспалительные средства, которые устраняют причину болезни.
Если есть возможность исключить механическое сужение просвета мочеиспускательного канала, проводят операции или другие манипуляции, освобождающие пути тока мочи. Восстановление работы нервных структур – это сложная задача, успех которой зависит от вида патологии нервов.
Остается сложным и неоднозначным лечение психогенных состояний, когда видимых нарушений органов и их функций нет, а признаки затрудненного мочеиспускания проявляются. В таком случае проводится длительный курс психотерапии. Только при комплексном подходе возможно восстановить утраченные функции мочевыделительной системы.
В любом случае важно своевременно обратиться за медицинской помощью при первых же проявлениях затруднения опорожнения мочевого пузыря.
Врачи клиник «МедЦентрСервис» обеспечивают комплексный подход к диагностике и лечению, чтобы быстро и правильно установить причину нарушений и как можно скорее избавить пациентку от дискомфортных и опасных симптомов.
Острая почечная недостаточность – это резкое и сильное снижение функции почек, тяжелое состояние, при котором нарушается выделительная функция. Возникает, как правило, вследствие ишемического (когда не хватает кровоснабжения в почке) или токсического воздействия на почки.
Содержание
- Симптомы
- Виды заболевания
- Диагностика
- Лечение

Почки очень чувствительны к воздействию ишемии (недостатка кровоснабжения) и токсических веществ из-за их уникальных анатомических и физиологических функций. Признаки почечной недостаточности возникают тогда, когда примерно три четверти нефронов (нефрон — структурная единица почек, которая непосредственно участвует в образовании мочи) перестают функционировать. До этого момента нет клинического проявления и при проведении диагностических тестов сложно выявить какие-то изменения.
Симптомы
Симптомы острой формы почечной недостаточности у кошек малоспецифичны:
- слабость,
- рвота,
- снижение аппетита или полный отказ от пищи,
- снижение количества мочи или полное отсутствие мочеиспускания,
- изменение пульса.
Все описанные симптомы относятся к тяжелым и должны быть устранены в кратчайшие сроки, от этого может зависеть прогноз при острой почечной недостаточности кошек.
Виды заболевания
Выделяют 3 вида заболевания:
- преренальная, когда причина находится вне мочевыделительной системы (падение артериального давления при шоке, кровотечении, сердечной недостаточности, обезвоживании и др.);
- ренальная, когда причина локализована непосредственно в почке. Такая форма недостаточности развивается при инфекциях и воспалительных заболеваниях почек, а также системных инфекциях, поражающих почки, например, при лептоспирозе. Кроме этого, причиной резкого снижения функции почек могут стать змеиный яд, лекарственный препараты — нестероидные противовоспалительные, химиотерапевтические, аминогликозиды. Так же к острой почечной недостаточности может привести пироплазмоз, при котором часто наблюдается массированный гемолиз ( разрушение эритроцитов), вследствие которого происходит закупорка почечных канальцев гемоглобином разрушенных эритроцитов и резко снижается фильтрующая способность почек. Подобное состояние может быть при отравлении гемолитическим ядом или сепсисе;
- постренальная, причина находится в мочевыделительной системе, но «ниже» почек, например, в мочеточниках, если по какой-то причине они сдавлены или их проходимость ограничена (новообразование, камни), в мочеиспускательном канале, чаще всего при его закупорке белково-солевыми пробками у кошек.
Есть животные с определенными патологиями, которых можно отнести к группе риска по острой почечной недостаточности. В первую очередь, это пациенты с тяжелыми заболеваниями сердца, имеющие хронические заболевания, такие как гепатит и сахарный диабет, и пациенты с тяжелыми септическими процессами.
Диагностика
Для диагностики доктору как обычно потребуется анамнез (подробный рассказ о том, как началось заболевание, какие симптомы наблюдаются, что ест, вакцинирован ли питомец), осмотр животного, анализы крови, мочи, УЗИ.
Постановка диагноза осуществляется на основании анамнеза, внешнего осмотра животного и результатов УЗИ и лабораторных исследований. Особенно обращают внимание на уменьшение количества выделяемой мочи (олигурия) или ее отсутствие (анурия).
Биохимический анализ крови показывает азотемию — увеличение содержания мочевины в крови, это важный показатель, характеризующий работу почек. Характерность особенностью ОПН у кошек является отсутствие признаков, которые характерны для ХПН — повышенная жажда, увеличение объема отделяемой мочи, снижение веса.
Лечение
Животные с ОПН — это пациенты отделения интенсивной терапии, которые должны находиться на стационарном лечении под постоянным наблюдением врача интенсивной терапии. Лечение острой почечной недостаточности у кошек сопровождается постоянным контролем животного – наблюдают за объемом выделенной мочи, мочевины и креатинина, биохимическими показателями крови, электролитами и газами крови, гематокритом, лейкоцитозом, следят за общим состоянием животного.
Лечение должно быть направлено на устранение причины, вызвавшей ОПН у питомца. Например, при закупорке уретры и острой задержке мочи обеспечивают отток мочи с помощью введения катетера в мочевой пузырь. Проводится коррекция жидкостного и кислотно-щелочного равновесия путем проведения внутривенной инфузии. Иногда прибегают к препаратам, усиливающим диурез.
Статья подготовлена врачами терапевтического отделения «МЕДВЕТ»
© 2014 СВЦ «МЕДВЕТ»
Читайте также:

