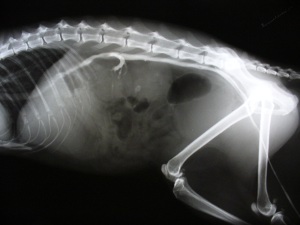
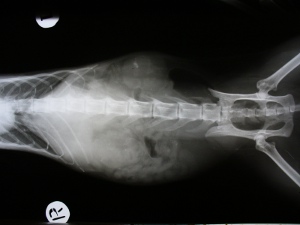
Что такое азотемия постренальная у кошек
Опубликовано: 02.05.2024

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
- Код по МКБ-10
- Эпидемиология
- Причины
- Факторы риска
- Патогенез
- Симптомы
- Стадии
- Формы
- Осложнения и последствия
- Диагностика
- Дифференциальная диагностика
- Лечение
- К кому обратиться?
- Профилактика
- Прогноз

Одним из вариантов нефротоксических поражений является азотемия – это состояние, сопровождающееся нарушением почечной функции на фоне избыточного содержания в кровотоке азотных соединений. Если течение такой патологии тяжелое, то возможно быстрое развитие острой почечной недостаточности.
Если перевести название «азотемия» с латинского языка, то оно буквально означает «азот в кровотоке». Иногда это состояние называют уремией – то есть, «мочой в кровотоке», но эти понятия не совсем одинаковы: азотемия обычно является основой уремии.
Суть патологии заключается в том, что при распаде белка выделяются такие азотистые соединения, как мочевая кислота, мочевина, креатинин, аммиак, пурины и индикан. Присутствие таких продуктов в крови и обусловливает развитие азотемии.
Код по МКБ-10
Эпидемиология
Интересно, что многие аспекты азотемии до сих пор остаются неясными. С учетом сказанного, азотемия довольно распространена, на нее приходится от 8% до 16% госпитализаций и, более того, она связана со значительно более высоким риском смерти. [1]
Азотемия является единственным достоверным критерием развития почечной недостаточности, в том числе и хронической её формы, при которой показатели сывороточного креатинина превышают 0,18 ммоль/литр, а мочевины – 8 ммоль/литр (норма – 0,12 ммоль/литр и 6 ммоль/литр соответственно). Об уремии говорят при понижении массы функционирующих нефронов менее 20-25% от необходимого количества, и при выраженной азотемии (уровень креатинина больше 0,45 ммоль/литр, при мочевине больше 25-30 ммоль/литр).
Частота первичного обнаружения азотемии составляет 5-20 случаев на сотню населения в год. Чаще всего патологию диагностируют у пациентов 45-65 лет. [2]
Причины азотемии
Кровь непрерывно фильтруется почками, что необходимо для выведения продуктов жизнедеятельности и поддержания электролитного равновесия в системе кровообращения. При уменьшении притока крови к почкам фильтрация притормаживается, что приводит к скоплению продуктов, которые должны выводиться из организма. Такое состояние может достигать уровня интоксикации.
Скопление азотистых соединений (к примеру, мочевины и креатинина) типично для состояния азотемии и способно значительно осложнить работу организма. Подобная патология провоцируется любыми нарушениями, ухудшающими почечное кровообращение – в том числе, недостаточной сердечной деятельностью, шоковым состоянием, обезвоживанием, сильной кровопотерей и пр. [3]
В целом, речь идет о таких причинах азотемии:
- расстройство почечного кровообращения, понижение перфузии вследствие падения объема циркулирующей крови, застойная сердечная функция, ослабевание системного сопротивления сосудов, понижение функционального артериального объема, что может быть вызвано сепсисом, гепаторенальным синдромом, неправильной работой почечной артерии;
- острая или хроническая почечная недостаточность, повреждение клубочков, канальцев, капилляров;
- двусторонняя обструкция мочеточника опухолями или камнями, забрюшинный фиброз, нейрогенный мочевой пузырь, обструкция мочепузырной шейки вследствие увеличения предстательной железы или аденокарциномы.
Азотемия может сочетаться и проявляться на фоне других патологий.
Факторы риска
Опасными факторами, имеющими значение в развитии азотемии, могут стать:
- травматическое шоковое состояние;
- краш-синдром, повреждение и омертвение мышечной ткани;
- электротравмы;
- термические повреждения (обморожения, ожоги);
- сильные потери крови;
- анафилактический шок;
- перитониты, панкреатиты, панкреонекрозы, холециститы;
- обезвоживание, нарушение электролитного равновесия, что может быть связано с изнурительной рвотой, поносом и пр.;
- тяжелое течение инфекционных патологий;
- бактериальный шок;
- патологии акушерства (сепсисы, эклампсия, послеродовые потери крови, нефропатия с преждевременной отслойкой плаценты и пр.);
- кардиогенный шок;
- интенсивная утрата жидкости при лихорадящих состояниях, физических перегрузках, ожогах;
- интенсивная утрата жидкости почками (при несахарном диабете, терапии мочегонными препаратами, заболеваниях почек с полиурией, декомпенсированном сахарном диабете и пр.);
- нарушенное поступление жидкости в организм.
В группу риска развития азотемии входят пациенты с повышенным уровнем артериального давления, сахарным диабетом, ожирением, а также лица в возрасте старше 50 лет, с различными заболеваниями почек (в том числе семейными), курильщики. Людям, входящим в группу риска, рекомендуется регулярно посещать врача для профилактического осмотра и сдачи основных клинических анализов. [4]
Патогенез
Мочевина является финальным продуктом белкового распада в организме, образуется в печени. В ходе выведения мочевины почками происходит выведение остатков «лишнего» азота. Частично выводится потовыми железами (что обусловливает специфический «аромат» пота).
Мочевина позволяет сохранять влагу в организме, нормализует минеральный обмен. Однако избыток этого вещества вредит тканям и органам. Его уровень зависит от равновесия процессов выработки и выведения из организма. Понижение концентрации отмечается на фоне низкобелкового питания, голодания, а также при печеночных патологиях, химических интоксикациях (мышьяком, фосфоросодержащими веществами), во время беременности или гемодиализа.
Клинически значимой считается азотемия, вызванная такими причинами:
- заболеваниями почек, при которых происходит нарушение выведения мочевины из системы кровообращения (пиелонефрит, гломерулонефрит, почечный амилоидоз, острая почечная недостаточность, гидронефроз);
- преимущественно белковым питанием, обезвоживанием, воспалительными патологиями, сопровождающимися усиленным белковым распадом;
- механической блокировкой выведения мочевины почками (камнеобразование, опухоли).
Азотемия вызывает увеличение присутствия в кровотоке мочевины, креатинина, мочевой кислоты, метилгуанидина, фосфатов и пр. Мочевина и креатинин прямо зависимы от степени дисфункции нефронов. Информация о токсичном воздействии креатинина отсутствует, а вот избыточное количество мочевины способно приводить к головной боли, апатии, миастении, артритам. С развитием хронической почечной недостаточности нарушается тубулярно-гломерулярный баланс, повышается белковый катаболизм. [5]
Симптомы азотемии
Клиническая картина при азотемии развивается по нарастающей прогрессии, в зависимости от поражения определенных органов и систем, а также от повышения уровня азотистых соединений в системе кровообращения.
Базовыми симптомами считаются такие:
- резкое уменьшение объема выделяемой мочи (олигурия), вплоть до полного прекращения (анурия);
- жажда, сухость слизистых и кожных покровов;
- появление кровотечений разного вида, кровоточивости, гематом и пр.;
- появление отеков, вплоть до генерализованной отечности мягких тканей;
- перепады показателей артериального давления;
- учащение сердцебиения.
На начальной стадии пациенты жалуются на появление слабости, утомляемость, апатию, ухудшение аппетита. Рано отмечаются признаки анемии, обусловленные кровопотерей, недостатком железа и сиженным образованием эритропоэтина. Со временем общая слабость и сонливость нарастают, появляется апатия (уремическая энцефалопатия), ослабление мышц с судорожными подергиваниями, возникает зуд кожи, парестезии, кровоточивость. Возможно развитие псевдоподагры. Симптоматика может нарастать стремительно или постепенно.
Картина тяжелой, необратимой при диализе, азотемии включает в себя выраженные диспептические явления (неукротимую рвоту, диарею, анорексию), стоматогингивит, хейлит, побледнение и пожелтение лица, сухость кожи. Значительно повышается артериальное давление, отмечается кардиомегалия, регинопатия, застойная сердечная недостаточность. Поражается костная система в виде остеопороза, остеомаляции. Неврологические симптомы представлены миопатиейи энцефалопатией.
У пациентов пожилого возраста нарастают признаки коронарного атеросклероза.
Первые признаки
Адекватное количество азота в кровотоке приравнивается к 18-40 мг/литр. Если это содержание по каким-либо причинам повышается, то говорят о развитии патологии, а именно – об азотемии.
Врачи говорят о таких основных признаках присутствия азота в крови:
- Нарушения, касающиеся пищеварительного тракта: запах кислоты или нашатырного спирта из ротовой полости, кишечные расстройства, тошнота с рвотой, профузная диарея (иногда – с кровянистыми прожилками), признаки анемии.
- Нарушения в работе нервной системы: дрожание мускулатуры рук и ног, эмоциональные перепады (апатия сменяется состоянием чрезмерного возбуждения), сонливость, затрудненное дыхание.
- Прочие нарушения (кровоточивость, сухость кожных покровов, общий зуд).
Указанные признаки, как правило, сочетаются друг с другом и говорят о развитии почечной недостаточности. Если лечебные меры не будут приняты своевременно, то картина усугубляется, а шансы на излечение снижаются.
Изменения в полости рта при азотемии
На приеме у врача при осмотре пациентов с азотемией можно отметить такие симптомы:
- общее побледнение кожи («анемический» цвет лица);
- потемнение ногтей;
- ссадины на коже, царапины, связанные с интенсивным зудом.
Пациенты жалуются на сухость в ротовой полости, боль в деснах, кровоточивость, изменение вкусовых ощущений, появление металлического привкуса и неприятного запаха. У отдельных пациентов отмечается боль в языке или внутренней стороне щек. Частота указанных патологических признаков непостоянна. К примеру, сухость в ротовой полости выявляется в 20-30% случаев, кровоточивость десен – практически в каждом втором случае, нарушение вкуса – в 25% случаев, а уремический запах изо рта можно наблюдать практически у 80% пациентов.
Достаточно распространенным сопутствующим заболеванием при азотемии становится уремический стоматит. Патология развивается при повышении мочевины в сыворотке больше чем на 150 мг/мл, но полная картина появления нарушения пока не выяснена. Патологические элементы чаще обнаруживаются на внутренней поверхности языка и слизистой ротовой полости. Стоматит плохо реагирует на лечение до нормализации уровня мочевины в крови, после чего излечивается самостоятельно на протяжении нескольких недель.
Стадии
Течение хронической азотемии подразделяется на курабельную и терминальную стадии. Курабельная стадия полностью обратима при своевременном назначении лечения и устранении причины патологии. Если же речь идет о тяжелом случае, когда период анурии продолжается в течение нескольких суток, то летальный исход может наступить в результате гиперкалиемии, ацидоза, нарушения водно-электролитного обмена.
Терминальная стадия характеризуется выраженным снижением клубочковой фильтрации с нарушением адаптивных механизмов почек. Ухудшают ситуацию повышенное артериальное давление, перикардит, нарушение кровообращения.
В терминальной стадии резко возрастает риск гибели пациента. Для продления жизни больного используют регулярный диализ. Летальный исход может наступить в результате нарушений сердечно-сосудистой деятельности, гиперкалиемии, инфекционных осложнений, сепсиса, геморрагий, а также вследствие развития уремической комы.
Формы
Азотемия имеет несколько классификаций, зависящих от причинного фактора появления нарушения. Однако все виды азотемии при почечной недостаточности обладают несколькими общими характеристиками: для них типично понижение скорости почечной клубочковой фильтрации и повышение азота мочевины в кровотоке и уровня креатинина в сыворотке. Используют индекс отношения азота мочевины к креатинину: этот показатель необходим для оценки типа азотемии. Нормальным индексным показателем считается
Copyright © 2011 - 2021 iLive. Все права защищены.
— Первым шагом в лечении хронической почечной недостаточности (ХПН) у кошек является выяснение, если это возможно, причины заболевания почек.
— Наиболее частым результатом гистологического исследования тканей почек у кошек с ХПН является выявление картины хронического интерстициального фиброза.
— После выявления причины возникновения ХПН должно быть начато специфическое лечение этой патологии почек.
— В лечении кошек с ХПН существенна информация о том, что и в каком количестве животные едят.
— Для ослабления клинической симптоматики уремии кошкам с ХПН следует ограничить содержание белка в рационе.
Хроническая почечная недостаточность (ХПН) — часто выявляемая патология у кошек. Частота выявления этой патологии нарастает с возрастом пациентов, и, по данным работы, ХПН обнаруживается у 1/3 всех обследованных старых кошек. Если учесть множественность аномалий в состоянии здоровья, обычно наблюдаемую у старых животных, ясно, что выявление и лечение ХПН требует значительных диагностических и терапевтических усилий. Несмотря на это, улучшение старых методов лечения и разработка новых в значительной мере облегчили решение проблем, встающих перед ветеринарными врачами, занимающимися терапией ХПН у кошек.
Этиология хронической почечной недостаточности
Под ХПН понимается состояние, при котором у больного наблюдается не менее 2 недель азотемия почечного происхождения. Азотемия — это повышение содержания в сыворотке крови азота мочевины (АМС) и креатинина (КС).
Первым шагом в лечении ХПН у кошек является выяснение, если это возможно, причины заболевания почек. Любой патологический процесс, сопровождающийся разрушением почечной ткани, может привести к ХПН. Соответственно, известно множество причин, вызывающих ХПН у кошек (Таблица 1). Идентификация причины ХПН в каждом конкретном случае обычно требует проведения следующих исследований: анализа биохимического профиля сыворотки крови, клинического анализа мочи, исследования микрофлоры мочи, рентгенографии брюшной полости и/или ее ультрасонографии. Больным ХПН, с почками нормальных или несколько увеличенных размеров, следует также проводить пункционную биопсию почек с последующим цитологическим исследованием полученных биоптатов.
К сожалению, у большинства кошек с ХПН, почки которых билатерально уменьшены в размерах, выявить причину ХПН не удается. Наиболее частым результатом гистологического исследования тканей почек у кошек с ХПН является выявление хронического интерстициального фиброза (называемого также хроническим тубулоинтерстициальным нефритом или хроническим интерстициальным нефритом). При этом заболевании почки уплотнены, уменьшены в размерах, их поверхность при пальпации через брюшную стенку неравномерно бугристая. Гистологическое исследование почечной ткани выявляет нарастающий интерстициальный фиброз с атрофией почечных канальцев разной степени, нефрокальциноз и гломерулосклероз. Хронический интерстициальный фиброз — это морфологический, а не этиологический диагноз. Поэтому он не является специфичным и, видимо, не отражает ответа почечной ткани на какое-либо конкретное заболевание. Вероятнее всего, интерстициальный фиброз — общий патогенетический результат конечной стадии развития любого повреждения почек у кошек, предшествующий появлению абсолютной почечной недостаточности.
Специфическое лечение возможно, если известна причина ХПН. У кошек с гломерулонефритом или нефротическим синдромом следует выявить причины, вызвавшее данные заболевания (например, лейкемию кошек или вирус иммунодефицита). Лечение при этом должно быть направлено на снижение выраженности протеинурии, отеков и, особенно, на ослабление воспалительного процесса в клубочках. Гипоальбуминемия, обусловленная потерей белка через капилляры клубочка, является исходной причиной отека, и поэтому соответствующее клиническое лечение требует точных знаний степени протеинурии. Лучше всего оценивать количество теряемого с мочой белка с помощью комплексной оценки содержания альбумина и креатинина в сыворотке (АС и КС) и отношения содержаний белка в моче (БМ) и КС (БМ/КС). Поскольку для кошек с ХПН характерна сильная вариабельность степени протеинурии, фоновое (до начала лечения) значение отношения БМ/КС следует определять у каждого больного как минимум дважды.
Выраженность протеинурии можно снизить ограничением количества белка в корме и/или приемом ингибитора ангиотензин-конвертирующего фермента (ИАКФ). Эти два способа лечения можно применять раздельно, с месячным интервалом, начиная с ограничения кормового белка. Эффективность назначенной терапии нужно контролировать путем определения АС, КС и БМ/КС у больного каждые 2 недели. После выбора соответствующей диеты можно оценить полезность применения ИАКФ (например, 0,5-2 мг/кг эналаприла per os каждые 24 часа или 0,25-2 мг/кг беназеприла также per os каждые 24 часа). Следует отметить, что изредка ИАКФ угнетает функцию почек у кошек с ХПН. Таким больным применение этих препаратов противопоказано.
Длительность эффективности применения ИАКФ и/или диеты с ограниченным содержанием белка следует контролировать путем определения БМ/КС, КС и АС каждые 2-6 месяцев. При возникновении отеков показано применение диуретиков, действующих в зоне петли Генле (например фуросемида в дозировке 1-2 мг/кг каждые 6-12 часов per os ), хотя эти препараты могут вызывать обезвоживание и ухудшение функции почек.
| Таблица 1 | |
| Первичные заболевания, которые могут привести к хронической почечной недостаточности у кошек | |
| Первичное место поражения | Заболевание |
| Тубулоинтерстициальная ткань | Хронический интерстициальный фиброз* |
| Пиелонефрит (бактериальный или грибковый) | |
| Гиперкальциемическая нефропатия | |
| Нефропатия из-за недостатка калия | |
| Инфекционный перитонит кошек (неэффузивная форма) | |
| Новообразования | |
| Амилоидоз | |
| Поликистоз почек | |
| Сосуды почек | Системная гипертония |
| Гломерулярная гипертония | |
| Внутрисосудистое свертывание крови | |
| Узелковый полиартериит | |
| Гипертиреоз (не доказано) | |
| Клубочки | Гломерулонефрит |
| Гломерулосклероз | |
| Собирающие трубочки/ почечная лоханка | Почечнокаменная болезнь |
| Периренальный псевдокистоз | |
* Хронический интерстициальный фиброз, вероятно, отражает изменения в морфологии почечной ткани на микроскопическом уровне при любом поражении почек у кошек, развившемся до конечной стадии почечной недостаточности.
| Таблица 2 | |
| Клиническая симптоматика уремии у кошек | |
| Симптом | Методы лечения |
| Потеря веса | Увеличение количества поедаемого корма |
| Рвота | Противорвотные препараты |
| Ограничение содержания белка в корме | |
| Коррекция электролитного и кислотно-щелочного балансов | |
| Гиперфосфатемия | Диета со сниженным содержанием фосфора |
| Лекарства, связывающие фосфор в тонком кишечнике | |
| Почечная остеодистрофия | Диета со сниженным содержанием фосфора |
| Препараты, связывающие фосфор в тонком кишечнике | |
| Кальцитриол | |
| Метаболический ацидоз | Подщелачивающие вещества в рационе |
| Гипокалиемия | Перевод на неподкисляющий рацион |
| Обогащение рациона калием | |
| Анемия | Поддержание необходимой калорийности рациона |
| Эритропоэтин | |
| Системная гипертония | Противогипертоническая терапия с или без снижения содержания натрия в рационе |
| Инфекции мочевыводящих путей | Антибиотикотерапия |
| Прогрессирование почечной недостаточности | Диета со сниженным содержанием фосфора |
| Противогипертонические средства (не доказано) | |
| Кальцитриол (не доказано) | |
К сожалению, мало известно об эффективности лечения нефротического синдрома и иммуноопосредованного гломерулонефрита у кошек иммуносупрессорами и противовоспалительными средствами. Можно опробовать применение таких препаратов для снижения воспалительного процесса в клубочках и возникающей протеинурии. Современные схемы, однако, рекомендуют начинать лечение с перевода животного на диету с пониженным содержанием белка и приема ИАКФ. У собак с выраженной протеинурией весьма часто наблюдается повышенная свертываемость крови, приводящая к тромбоэмболии, однако у кошек с нефротическим синдромом такое наблюдается редко. Поэтому применение антикоагулянтов типа аспирина или кумарина для кошек не рекомендуется.
Другими причинами возникновения ХПН у кошек могут быть бактериальная инфекция почек, периренальный псевдокистоз, почечнокаменная болезнь и лимфосаркома почек. В таких случаях специфическое лечение должно быть направлено на первичное заболевание.
Проблемы ранней диагностики
Все метаболические и клинические аномалии у больного с подозрением на ХПН должны быть выявлены на такой ранней стадии патологического процесса, как только это возможно. Эти аномалии часто остаются на субклиническом уровне в течение нескольких недель или даже месяцев, прежде чем владелец животного обратится к ветеринарному врачу. Для выявления заболевания на ранних стадиях врач должен воспользоваться для обследования животного самыми чувствительными методами анализа, такими как биохимический анализ сыворотки. Это гораздо проще, чем лечить животное с тяжелой клинической симптоматикой. Даже поддерживающее лечение должно быть строго индивидуальным, основанным на результатах функционального и лабораторного исследования больного. Обследование кошек следует проводить каждые 2-6 месяцев или даже чаще, если у них выявляются признаки нестабильности или уремии.
Особенности кормления кошек
Необходимо следить за тем, чтобы животное получало нужное количество воды и энергии. При лечении ХПН количество потребляемого корма столь же важно, как и его качество. Поскольку у кошек с ХПН часто бывает пониженный аппетит, разработанные для лечения этой патологии рационы отличаются разнообразными вкусовыми характеристиками. Ветеринарный врач должен тщательно регистрировать все изменения веса тела животного. Владелец, в свою очередь, должен внимательно регистрировать количество потребляемого кошкой корма, сообщая о своих наблюдениях врачу при каждом посещении. Количество необходимой энергии у разных кошек сильно варьирует. Идеальное поступление энергии обеспечивает нормальную активность и нормальный вес тела. Недостаточное энергетическое обеспечение — примерно 4 мг/дл, или при системной гипертонии эти исследования должны проводиться чаще. Раз в год у животных следует изучать биохимические показатели крови и полную ее клеточную формулу.
Хроническая почечная недостаточность (ХПН) видимое клиническое проявление нарушения функции почек, вызванное необратимой гибелью нефронов при прогрессирующем заболевании почек. Это обычно наблюдается при потере 75% функциональной массы почек и проявляется многосимптомным комплексом, отражающим участие в этом процессе практически всех органов и систем больного животного. В ретроспективных исследованиях, где преобладали кошки старше 7 лет, не было выявлено ни половой ни породной предрасположенности [1].
Хроническая почечная недостаточность (ХПН)
В опыте нашего ветеринарного центра подтверждаются данные приведенные Di Bartola. Среди наших пациентов также преобладали животные старше 7 лет, самцы и самки встречались с одинаковой периодичностью.

В ветеринарных клиниках кошек с ХПН среди всех пациентов от 10 до 30% [3]. В нашей клинике кошек с ХПН на терапевтическом отделении порядка 28-30% от общего количества пациентов.
Этиология
ХПН развивается там, где есть давние, необратимые повреждения почек, вследствие чего они теряют свою экскреторную (выведение продуктов обмена), регулирующую (поддержка объема и состава жидкости в организме) и эндокринную функции (выработка гормонов ренина, эритропоэтина и др.).
Причинами ХПН являются первичные или вторичные ренальные процессы, которые, как правило, продолжаются длительное время и приводят к конечной стадии – сморщенной почке. Такие как:
- поликистоз почек (наследственное заболевание, в основном у персидских и экзотических кошек),
- воспалительные заболевания почек (пиелонефрит, гломерулонефрит),
- болезни обмена веществ (сахарный диабет кошек и собак, амилоидоз),
- мочекаменная болезнь,
- врожденное недоразвитие почек (гипоплазия)
- опухоли почки - например, лимфома,
- другие причины - например, повреждение почек токсинами.
На фото: Поликистоз почек, болезни почек у кошек. Исследование контрастным веществом Омнипак 300.
Однако, в большинстве случаев, точная причина заболевания кошек неизвестна.
Патогенез
В патогенезе ХПН, независимо от почечной патологии, снижение почечных функций происходит за счет 3-х основных механизмов:
- уменьшения количества функционирующих нефронов,
- значительного снижения скорости фильтрации в каждом отдельном случае без уменьшения числа нефронов,
- сочетания первого и второго механизмов.
Следствием действия каждого из этих факторов будет снижение скорости клубочковой фильтрации - скорость, с которой происходит фильтрация веществ из крови через клубочки нефронов. Уменьшение числа функционирующих нефронов постепенно приводит к существенному изменению биохимических показателей крови и тяжелым обменным нарушениям.
Отмечается развитие уремии с накоплением потенциальных токсинов и продуктов метаболизма белков: мочевины (более 10 ммольл [2]), креатинина (более179 ммольл [3]), мочевой кислоты.
По современным представлениям синдром уремической интоксикации обусловлен не задержкой азотистых шлаков, а главным образом накоплением в крови средних молекул - белковых веществ, имеющих молекулярную массу от 300 до 500 дальтон, образующихся в результате нарушения гомеостатической функции почек [5].
Повышение в крови продуктов азотистого метаболизма - осмотически активных веществ - увеличивает осмотическую нагрузку на оставшиеся нефроны. Эти вещества, профильтровавшись в клубочках, в меньшей мере, чем в норме, реабсорбируются в канальцах. Нереабсорбировавшаяся часть их выделяется с мочой вместе с соответствующим количеством воды. Это называется осмотическим диурезом. За счет осмотического диуреза общее выделение почками воды не только сохраняется нормальным, но даже может быть увеличенным (полиурия), несмотря на значительное снижение клубочковой фильтрации. Плотность мочи при этом снижается и становится стабильной на уровне 1,008—1,015, что соответствует плотности крови и указывает на снижение концентрационной способности почек.
Полиурия приводит к потере организмом воды (дегидратация). При дегидратации снижается почечный кровоток, ухудшается клубочковая фильтрация и усугубляется ХПН. При ХПН нарушается метаболизм кальция и фосфора. По мере прогрессирования ХПН падают выделение кальция с мочой и его всасывание в кишечнике, содержание фосфатов в крови повышается. Указанные нарушения сопровождаются изменениями в костной ткани — остеодистрофией. Нарушения обмена электролитов приводят к изменениям в нейромышечной системе, сопровождающимся адинамией, параличами и другими нарушениями. ХПН сопровождается изменениями во всех видах обмена веществ. На ранних стадиях нарушается энергетический обмен -расходование энергии превышает возможности энергообразования.
Стадии почечной недостаточности кошек
1. Латентная стадия заболевания почек (ранняя).
Характеризуется снижением скорости клубочковой фильтрации, однако это не сказывается на общем состоянии животного и концентрации креатинина в крови
2. Начальная стадия ХПН.
Наблюдается умеренная азотемия, концентрация креатинина в сыворотке крови - до 250 мкмоль/л. Прогрессирование данной стадии заболевания может длиться несколько месяцев, сопровождается снижением аппетита, потерей массы тела, периодической рвотой. Компенсация может вызвать гиперпаратиреоидизм, снижение концентрационной способности почек.
3. Консервативная стадия ХПН.
Происходит дальнейшее снижение скорости клубочковой фильтрации, развивается высокая уремия, концентрация креатинина в сыворотке крови составляет 252 - 440 мкмоль/л. На данной стадии характерна полидипсия, возможно появление клинических признаков обезвоживания анемии, нарушения работы ЖКТ, метаболический ацидоз.
4. Терминальная стадия ХПН.
О терминальной стадии ХПН свидетельствуют не только высокие показатели мочевины и креатинина в крови, но и гипокальциемия (вплоть до развития судорог), симптомы уремической энцефалопатии, гиперфосфатемия, картина декомпенсированного уремического ацидоза (дыхание Куссмауля), интерстициальный отек легких. При длительной тяжелой азотемии жизнь невозможна без диализа или трансплантации почки [2].
По данным Douglas Slatter есть 3 фазы почечной недостаточности.
1 фаза. Заболевания почек, которые первично повреждают почечную ткань (гломерулонефрит, мочекаменная болезнь, гипертензия). Не оказывает существенного влияния на жизнь животного и не сказывается на концентрации креатинина в крови.
2 фаза. Почечная недостаточность с незначительными клиническими проявлениями. Уровень креатинина 179 – 354 мкмольл.
3 фаза. Уремия, с явными клиническими проявлениями и креатинином крови свыше 354 мкмольл.
В нашей практике мы условно разделили ХПН на три стадии по уровню креатинина в крови:
1. Начальная стадия - когда уровень креатинина не поднимается выше 250 мкмольл – при этом у таких животных может не быть никаких клинических проявлений болезни, или они незначительны. Таких кошек за последний год было 38% (от общего количества кошек страдающих ХПН).
2. Средняя – уровень креатинина крови до 500 мкмольл. Имеются явные клинические признаки заболевания (полиурия, полидипсия, нарушение функции ЖКТ, анемия, истощение). Таких кошек около 28%.
3. Терминальная – уровень креатинина выше 500 мкмольл. Полный набор клинических признаков, вплоть до летаргии. Таких кошек от общего числа страдающих ХПН – 34%.
Клинические признаки
- Анорексия, подавленность
- Рвота обусловленная гиперацидным гастритом, полидипсия, полиурия. Гингивит с язвами на кончике языка. Анемичные слизистые оболочки. Наблюдается вторичный гиперпаратиреоз с размягчением костей лицевого черепа.
- Констипация, обезвоживание
- При пальпации можно обнаружить изменение размеров почек, чаще всего они уменьшены, если ХПН вызвана амилоидозом, гидронефрозом, опухолями – наблюдается увеличение почек.
- Уремическая энцефалопатия: кома, тремор, эпилептиформные припадки, тетеания.
- Аритмия брадикардия. Повышение артериального давления, гипертрофия левой половины сердца. Ацидоз вызывает углубление дыхания.
- Иммунная депрессия, обызвествление мягких тканей, нарушение свертываемости крови, резистентность к инсулину (повышение уровня глюкозы в крови), нарушение работы поджелудочной железы (гиперамилаземия). Истончение волоса, плохое качество шерсти.
- У кошек с терминальной стадией ХПН наблюдается летаргия.
Диагностика
ХПН можно диагностировать болезнь животного по клиническим симптомам, но они могут быть и неспецефическими, т.к. подавленность, летаргия, отсутствие аппетита и потеря веса наблюдаются при многих заболеваниях. Для подтверждения диагноза требуются лабораторные исследования. В нашей клинике мы используем чаще всего биохимический и клинический анализы крови и анализ мочи, во многих случаях проводим ультразвуковое исследование почек.
Определяются повышенный уровень мочевины, азота мочевины и креатинина. Определение креатинина в крови имеет большее значение, чем определение мочевины, т.к уровень креатинина не подвержен влиянию диеты или уровню расщепления белков.
Также можно определять скорость клубочковой фильтрации: определяют объем и концентрацию креатинина в моче за сутки и коррелируют с уровнем креатинина в сыворотке крови.
Симптомы отсутствия аппетита наблюдаются при уровне мочевины более 25 ммольл, при содержании мочевины 40 ммольл (норма 5-10 ммольл) у животного будут наблюдаться сильное угнетенение и анорексия.
Недостаточное выведение огранического фосфора приводит к подъему его уровня в крови, в то время как уровень кальция падает (при ХПН средней тяжести уровень фосора не более 2,1 ммольл, при тяжелой форме ХНП более 3,2 ммольл).
Высвобождение кальция из костей при высоком уровне фосфора приводит к минерализации мягких тканей. У большинства кошек с ХПН наблюдается гипонатриемия иили гипокалиемия, гипоальбуминемия, гиперамилаземия. Нерегеративная анемия, гипокалиемия. Изостенурия, плотность мочи 1008 и ниже.
Преобладает следующая картина: нерегенеративная анемия вызванная снижением производства почками эритропоэтина и уменьшением срока жизни циркулирующих эритроцитов, лейкоцитоз с лимфопенией и тромбопенией.
Изостенурия (осмоляронть обычно ниже 1015), рН изменяется в кислую сторону, протеинурия, неактивный мочевой осадок, редко глюкозурия.
Повышение эхогенности почечной паренхимы, размытость границ коркового и медиального слоя, уменьшение размеров почек.
Определяется уменьшение размеров почек менее 2,5 кратной длины тела второго поясничного позвонка (L-2). Если наблюдается явный гиперпаратиреодизм, то видно снижение плотности костей, особенно верхней челюсти и кальцификация мягких тканей.
Дифференциальный диагноз
Дифференцируют от острой почечной недостаточности (ОПН), преренальной и постренальной уремии.
При ОПН отсутствует анемия, полиурия и полидипсия, уменьшение почек, зато присутствуют анамнестические признаки экстраренального основного заболевания.
Гломерулонефрит сочетается с сильной протеинурией, при этом размеры почек в норме, тенденции к отекам.
При пиелонефрите в анализе мочи активный мочевой осадок, пиурия. Почки могут быть неправильной формы, расширение лоханки и мочеточников на УЗИ. Лейкоцитоз крови.
От полидипсии без задержки мочевины, Diabetes mellitus, Dibetes isipidus centralis and renalis, психогенной тяги к питью.
При гистопатологическом исследовании почек (биопсия) при ОПН наблюдается:
- острый некроз канальцев
- острое воспаление
- значительная часть нормальной паренхимы заменена фиброзной тканью,
- обширная атрофия канальцев,
- кальцификация базальных мембран,
- хроническое воспаление (хронический интерстициальный нефрит),
- гломерулосклероз
Лечение
Чаще всего болезни почек у кошек диагностируется без ясного представления о ее причине, поэтому лечение направлено на устранение основных симптомов. Цели проводимой терапии:
- поддержание качества жизни,
- замедление дегенерации поврежденных почек и прогрессирования ХПН,
- снижение азотемии,
- снижение протеинурии,
- снижение риска гипертензии.
Анорексия и обезвоживание: внутривенное или подкожное введение растворов 0,18% натрия хлорида + 4% декстрозы. Необходимый объем вводимых растворов рассчитывается из необходимости 50 млкг24 часа
Системная гипертензия: ингибиторы АПФ или блокаторы кальциевых каналов (эналаприл 0,25-0,5 мгкг per os, каждые 12-24 часа, амлодипин 0,10-0,25 мгкг per os, каждые 24 часа).
Метаболический ацидоз: бикарбонат натрия 8-15 мгкг per os, каждые 8-12 часов.
Гипокалиемия: раствор Хартмана, Панангин.
Гиперфосфатемия: диета с низким содержанием фосфора (Royal Canine renal, Hill’s kd, Eucanuba renal, Pro Plan NF), содержание фосфора не более 0,6% от суточного рациона. Введение препаратов связывающих фосфор в ЖКТ алюминия гидроксид 30-60 мгкг в сутки с кормом.
Потеря веса: высококалорийная диета, стимуляция аппетита различными привлекателями вкуса, парэнетеральное питание, носопищеводный зонд
Протеинурия и гипоальбумиемия: ингибиторы АПФ эналаприл 0,5 мгкг per os, каждые 12-24 часа – снижают экскрецию белка почками при их повреждении. Диета насыщенная омега 3- полиненасыщенными жирными кислотами.
Иммунная супрессия: ежегодная вакцинация и оберегание животного от потенциальных источников инфекции.
Снижение аппетита и рвота: диета со сниженным уровнем белка при уровне мочевины более 40 ммолл, антагонисты Н2 рецепторов (фамотидин 0,5 мгкг per os, каждые 12-24 часа, метоклопрамид 0,2-0,4 мгкг per os, подкожно, каждые 6-8 часов.
Анемия: при гематокрите ниже 18% эритропоэтин 25-100 едкг, подкожно 1-3 раза в неделю, сульфат железа 5-20 мгкг в сутки per os.
Выводы
1) ХПН –это необратимая прогрессирующая деструкция ткани почек в результате заболеваний, которые в отсутствие диализа или трансплантации почки приводят к смерти пациента.
2) У кошек с ХПН симптомы могут отсутствовать до тех пор, пока скорость гклубочковой фильтрации не станет очень низкой.
3) Следствием ХПН является нарушение метаболизма воды и натрия, кальция и фосфора, анемия.
Роман-А. Леонард,
к.в.н., практикующий ветеринарный врач, президент Российской научно-практической ассоциации ветеринарных нефрологов и урологов (НАВНУ, www.vetnefro.ru)
В статье использованы фото ветеринарного офтальмолога Веры Олейник.
Введение
Диагностика такой широко распространённой во всём мире нефропатии кошек, как ХБП 1 , в подавляющем числе случаев осуществляется ветеринарными специалистами лишь на основании повышения уровня креатинина и мочевины в сыворотке крови. С азотемией (или т. н. уремической интоксикацией) традиционно, хотя и необоснованно, связывают и большую часть клинических проявлений заключительных этапов почечного континуума.
Даже если отбросить в сторону то обстоятельство, что креатинин и мочевина — это в большей степени лишь биомаркеры почечного поражения 2 , а не факторы патогенеза и «виновники» большинства осложнений клинического этапа ХБП, необходимо учитывать и тот факт, что далеко не всегда у животного, погибающего от этой асептической нефропатии (по причине ряда тяжелейших её осложнений: гидроторакса, гидроперикарда, метаболического ацидоза, гиперпаратиреоза, гипертонии и т. д.), азотемия превышает общепринятые 3 референтные значения.
Впрочем, возможна и обратная ситуация, когда у клинически здорового животного с безупречными анализами мочи и крови уровень креатинина значительно повышен и выявляется случайно, например при скрининге или при подготовке к рутинной хирургической операции (овариоэктомия и проч.).
Говоря в целом, уровень азотемии далеко не всегда позволяет оценить степень тяжести почечного поражения. Поэтому практически всегда требуется проведение совокупной оценки всех имеющихся у пациента изменений как в общем состоянии, так и отклонений, выявляемых при неинвазивных и, если требуется, инвазивных методах диагностики.
К несчастью, нередки случаи, когда на приём к врачу попадают пациенты с катастрофическими изменениями в ренальной паренхиме и, как следствие этого, набором патологических изменений в структуре/работе различных органов и систем. Но в нефрологическом диагнозе и, соответственно, в жизненно необходимом лечении таким животным необоснованно отказывают лишь на основании того, что уровень азотемии у них находится в пределах формальной нормы. Мало того, на основании некорректных диагнозов таким пациентам могут быть назначены препараты, обладающие абсолютными и относительными 4 нефротоксичными свойствами.
Как же диагностировать ХБП, если азотемия в этом деле не слишком надёжный помощник?
Может возникнуть вопрос: как же определить эти самые тяжёлые структурные изменения в почечной паренхиме, если у пациента отсутствует азотемия? Ведь пункционная нефробиопсия с последующими гистоморфологическими исследованиями почечного биоптата — это сложно, опасно, дорого и долго.
Но тут далеко не всё так страшно, как кажется на первый взгляд. Прежде всего, ценность инвазивных методов диагностики нефропатий высока лишь на ранних доклинических этапах их течения. Только тогда результаты исследования могут значимо повлиять на долговременную стратегию нефропротективной терапии. На клиническом этапе ХБП (а он, как уже было сказано, далеко не всегда гиперазотемический) в почечной паренхиме обычно выявляются ярко выраженные, но весьма однотипные структурные изменения, представляющие различные этапы процессов ренальной деструкции, неминуемо ведущие к единому итогу — нефросклерозу. Результаты пункционной нефробиопсии на клиническом этапе ХБП (т. е. у пациентов, у которых не менее 75% почечной паренхимы находятся в состоянии частичной или полной деструкции) никак не способны повлиять на симптоматическую/заместительную терапию, лишь только и возможную в этом случае.
А что же расскажет врачу о тяжёлой почечной деструкции, если не инвазивные методы диагностики? Тут всё весьма банально. И при правильно поставленной работе точно не страшно, не дорого, быстро и экономически целесообразно. В 99% случаев вся необходимая информация будет в анализах мочи. Да, именно, о процессах деструкции в почечной паренхиме и даже об их выраженности может рассказать простой общеклинический анализ мочи. Поскольку протеинурия, гипостенурия, агранулоцитарная лейкоцитурия и проч. безапелляционно об этом свидетельствуют, и давно доказана прямая корреляция этих изменений и степени тяжести необратимого почечного поражения.
Из этого, с одной стороны, следует, что постановка какого угодно нефрологического диагноза на любом этапе почечного континуума невозможна без исследования мочи (исключением, пожалуй, могут быть названы только анурические состояния), а необоснованное пренебрежение этим легкодоступным, высокоинформативным и высокоприбыльным методом диагностики является врачебной ошибкой 5 . А с другой стороны, особенно если пациент кошка, множество различных патологических изменений, с жалобами на которые владельцы обращаются в клинику, прямо или косвенно могут быть связаны с различными нефропатиями, и прежде всего с ХБП. А следовательно, рекомендация о необходимости исследования мочи у кошек должна быть дана одной из первых, вне зависимости от наличия/отсутствия клинических проявлений и изменений в анализах крови.
Установление степени почечного поражения у пациентов является важным ещё и потому, что заключительные этапы почечного континуума накладывают как минимум существенные ограничения на использование большинства лекарственных препаратов, поскольку их фармакодинамика и фармакокинетика неразрывно связаны с почками (в т. ч. и поэтому возможно накопление нефротоксичных эффектов даже у средств, проявляющих в иных условиях нефропротективные свойства). Эти обстоятельства обязательно должен учитывать курирующий пациента врач, а узкие специалисты, к которым в случае необходимости животное может быть направлено на консультацию, должны быть проинформированы о почечном статусе пациента и об ограничениях в терапии, который он накладывает.
К примеру, ухудшение качества кожи и шерсти, говоря в общем даже без привязки к какой-либо нозологической форме, весьма распространённая причина обращения в ветеринарную клинику. (А если владельцы не обращают на эту проблему особого внимания, списывая всё, например, на возраст, сухость и жару в квартирах, хроническую линьку и т. д., то врач при первой возможности должен проинформировать их о необходимости и возможных вариантах установления причины появления у животного трихо- и/или дермопатии.) И у таких кошек наверняка будут значимые и стойкие отклонения в анализах мочи. А следовательно, есть все основания для того, чтобы предположить, что вышеназванные изменения являются осложнением ХБП (или усугубляются ей), которые автор предлагает обозначать как нефрогенный дерматит, или уремическая дерматопатия, если так проще объяснить самому себе или владельцам пациента причину развития этого осложнения — патологическое воздействие на структуры кожи разнообразных биологически активных веществ (прежде всего паратиреоидного гормона), накопление которых является прямым или косвенным следствием декомпенсированной почечной недостаточности.
Ещё одним относительно ранним, распространённым и наглядным осложнением ХБП является поражение глазного дна (снижение светочувствительности сетчатки обычно приводит к легко диагностируемому симптому — патологическому билатеральному мидриазу), а то и глазного яблока в целом (фото 1–6).
 |  |
| Фото 1. Кошка, 15 лет. Дегенерация сетчатки | Фото 2. Кошка, 14 лет. Отслойка и геморрагии сетчатки |
 |  |
| Фото 3. Кошка, 15 лет. Гемофтальм | Фото 4. Кошка, 13 лет. Отслойка сетчатки |
 |  |
| Фото 5. Кошка, 13 лет. Отслойка сетчатки, гемофтальм | Фото 6. Собака, 12 лет. Отслойка сетчатки, гемофтальм |
Не секрет, что системная гипертензия (в т. ч. и ренальная, тяжесть которой напрямую коррелирует с уровнем протеинурии и гипостенурии) опасна у кошек прежде всего необратимым поражением органов-мишеней, одним из которых являются глаза. Поэтому не стоит с порога отправлять пациента к окулистам, поскольку без терапии основного заболевания и попыток поставить под контроль уровень системной гипертензии заниматься лечением в т. ч. и офтальмологических осложнений ХБП, очевидно, не имеет смысла. А определиться с нефрологическим диагнозом, разъяснить владельцам причины возникших вторичных изменений 6 и назначить необходимое пациенту лечение должен, по крайней мере, терапевт, если по какому-то недоразумению в клинике, в которой ведётся приём кошачьих, всё ещё нет ветеринарного нефролога-уролога. А уж потом, при большом желании владельцев, можно и направить пациента с ХБП к узкоспециализированным ветеринарным специалистам. И здесь ни в коем разе нет пренебрежения к уважаемым коллегам, а только огромное желание, чтобы умирающих от ХБП животных, которым «не повезло» с уровнем азотемии, лечили и от основного заболевания, а не только от его разнообразных осложнений, так ловко, зараза их возьми, маскирующихся под разные иные патологии.
Симптомы ХБП, возникающие на её клиническом этапе у пациентов в т. ч. с уровнем азотемии, находящимся в пределах референтных значений, и основные/наиболее вероятные причины их развития приведены в таблице 1.
Оценка степени тяжести ХБП у конкретного пациента требует, возможно, более полной оценки как различных клинических проявлений, так и результатов лабораторных и визуализирующих (т. е. неинвазивных) методов диагностики (а в случае, когда к этому есть показания, также и инвазивных). Поэтому при осмотре необходимо указать владельцам на все, даже на первый взгляд незначительные, изменения в состоянии животного. Именно такой комплексный подход (по совокупности признаков, а не основанный лишь на уровне отдельных лабораторных показателей, например креатинина) поможет и в постановке корректного нефрологического диагноза (на максимально ранних этапах почечного континуума). И при работе с владельцами, которым необходимо детально разъяснить значимость/опасность патологии и возможности (или отсутствие таковых) профилактики и лечения её на различных этапах.
Благодарности
Автор выражает признательность за предоставленные фотографии и поддержку в профессиональной деятельности замечательному офтальмологу Вере Олейник (Московский ветеринарный центр глазных болезней доктора Олейник).
Примечания
1 Хроническая болезнь почек.
2 Наряду с активно внедряемым в последнее время в клиническую практику симметричным диметиларгинином.
3 Вернее, установленные Международным обществом изучения заболевания почек (у мелких домашних животных) — IRIS (www.iris-kidney.com).
4 Степень нефротоксичности у таких препаратов во многом зависит от степени тяжести почечного поражения.
5 А в нефрологическом центре, которым руководит автор статьи, факт подобного пренебрежения расценивается как вражеский демарш и махровый коллаборационизм, направленные на подрыв экономического суверенитета лечебного учреждения (ст. 12-8а УК УЦВНиУ: расстрел на рассвете).
6 В случае с офтальмологическими осложнениями ХБП владельцев необходимо изначально проинформировать о том, что восстановления зрительной функции у пациента, скорее всего, не произойдёт. Это в последующем позволит избежать ряда претензий с их стороны.
Таблица 1
2. Поражение паратиреоидным гормоном рвотного центра (тошнота, рвота) и структур ЦНС, отвечающих за формирование чувства голода и физиологически обусловленных вкусовых предпочтений.
2. Формирование порочного круга рено-кардиального и кардио-ренального континуумов: усугубление тяжести системной гипертензии.
2. Тромбоз лёгочных артерий на фоне системной гипертензии (положение усугубляется ещё и высокой порозностью этих артерий, свойственной кошкам).
1 Термин «уремический» совершенно не отражает всё многообразие нарушений в организме, возникающих на клиническом этапе ХБП, и фактически увязывает патогенез этой многофакторной нефропатии лишь с накоплением в организме конечных продуктов азотистого обмена. А также ставит знак равенства между степенью тяжести ХБП и уровнем азотемии. Что в корне неверно. Поэтому закостенелый термин «уремический» употребляется в данной статье лишь отдавая дань традиции и для некоторого облегчения понимания материала врачами, только недавно начавшими интересоваться ветеринарной нефрологией.
2 Капель, расширяющих зрачок, дорогих и очень дорогих офтальмоскопов, высококвалифицированных офтальмологов и т. д., хотя последнее, конечно, и не возбраняется, если у кошки уже определён нефрологический статус или офтальмологическое обследование проводится параллельно с этим.
3 Поэтому предложение, высказанное в одной известной песне «да загляни-ка в глазки ей…» может помочь не только в поиске определённого рода сокровищ, но также, например, и в установлении почечного статуса будущей избранницы.
4 Крайне неблагоприятный с прогностической точки зрения симптом ХБП, свидетельствующий о вовлечении в её патогенез сердечной и дыхательной систем. Прежде чем приступать к осмотру животного или любым иным действиям с ним (например, к термометрии, фиксации, постановке в/в катетера и т. д.), необходимо отойти от пациента в сторону и проинформировать владельцев о том, что животное может в любой момент погибнуть от острой полиорганной недостаточности.
Срок исполнения
1 рабочий день (плюс 1-2 для регионов)
Исследуемый материал
Метод определения
Энзиматический, уриказа, фотометрия
В результате катаболизма аминокислот в печени образуется значительное количество аммиака (NH3). Аммиак является относительно сильным основанием и при физиологических значениях рН присутствует в основном в виде иона аммония (NH4+). NH3 и NH4+ токсичны и в высоких концентрациях вызывают повреждение тканей, в частности, головного мозга, приводя к нарушению метаболизма глутамата.
Поэтому в организме конечные продукты азотистого обмена преобразуются в нетоксичные растворимые соединения и выводятся из организма. Выведение таких продуктов может осуществляться различными способами. Водные животные (например, рыбы и водные рептилии) могут выделять непосредственно NH4+ (аммониотелики).
В организме птиц и рептилий образуется мочевая кислота, которая выделяется в основном в виде твердого вещества с целью экономии воды (урикотелики). Большинство водных черепах являются урео-урикотеликами, и, в зависимости от условий, конечным продуктом катаболизма азота у них являются мочевина и мочевая кислота. В организме наземных позвоночных (уреотелики) большая часть аммиака под действием ферментов превращается в мочевину в печени и экскретируется почками. Небольшое количество мочевины способны синтезировать астроциты мозга. У жвачных животных существует румено-гепатическая циркуляция азота, необходимая для сохранения азота в организме. При этом образовавшаяся в печени мочевина со слюной возвращается в рубец, где она расщепляется бактериальной уреазой до углекислого газа и аммиака, который служит источником питания микрофлоры рубца.
У лошадей в слепой кишке и толстом отделе кишечника присутствует уникальная микрофлора, которая преобразует азот мочевины в аминокислоты, но с меньшей эффективностью, чем у жвачных, осуществляя, тем самым, экскрецию азота мочевины. После синтеза в печени мочевина поступает в кровеносное русло и может свободно дифундировать между жидкими средами организма. В почках она участвует в процессе концентрирования мочи, задерживаясь в интерстициальном пространстве вместе с натрием и хлором. Именно мочевина и натрий в интертициальном пространстве способствуют пассивной реабсорбции воды из канальцев.
Снижение концентрации этих веществ в медуллярной зоне почек предполагает снижение уровня образования мочевины и наблюдается при гипоадренокортицизме (при длительной гипонатриемии) и длительном подавлении синтеза мочевины в результате наличия портосистемных шунтов (врожденных или приобретенных), а также при тяжелой хронической печеночной недостаточности. У кошек и собак удаление азота из организма происходит посредством экскреции мочевины. Мочевина свободно фильтруется в почечных канальцах, приблизительно 50% ее пассивно реабсорбируется в проксимальных отделах почечных канальцев, около 10% мочевины активно (под действием антидиуритического гормона (АДГ)) реабсорбируется в собирательных трубочках. Величина реабсорбции мочевины в канальцах зависит от скорости тока мочи по канальцам, уровень мочевины в сыворотке крови используется для оценки скорости клубочковой фильтрации (СКФ). Со снижением СКФ увеличивается интенсивность реабсорбции мочевины, и возрастает ее уровень в крови. Однако, поскольку уровень мочевины и креатинина в сыворотке крови не увеличиваются вплоть до поражения 60-75% нефронов, определение концентрации этих показателей не является информативным в ранней диагностике почечной недостаточности. К наиболее распространенным причинам увеличения уровня мочевины в сыворотке крови относятся гиповолемия и желудочно-кишечные кровотечения. К другим причинам увеличения уровня мочевины в крови можно отнести усиление катаболизма белка (например, при употреблении высокобелковой пищи), но при этом, как и при усиленном мышечном катаболизме, азотемии у здоровых животных не возникает. Длительное применение кортикостероидных препаратов также может быть причиной повышения концентрации мочевины в крови.
ПРЕАНАЛИТИКА
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 1 неделю при температуре хранения +2°С…+8°С. Гемолиз может завышать результаты исследования.
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения лаборатории VET UNION: ммоль/л.
Референсные значения:
Собаки: 3-9 ммоль/л.
Кошки: 3,5-12 ммоль/л.
Лошади: 4,3-9,2 ммоль/л.
КРС: 3,5-9,2 ммоль/л.
МРС: 6,4-11 ммоль/л.
Хорьки: 3,6-15,5 ммоль/л – альбиносы; 4,2-11 ммоль/л – темные.
Кролик: 2,5-4,9 ммоль/л.
Крыса: 2,4-3,4 ммоль/л.
Морская свинка: 1,5-5,3 ммоль/л.
Мышь: 2,8-4,6 ммоль/л.
Песчанка: 2,8-4,5 ммоль/л.
Хомяк:1,9-4,3 ммоль/л.
Шиншилла:2,8-7,5 ммоль/л.
Тигр:3,1-18,3 ммоль/л.
Леопард: 3,1-18,3 ммоль/л.
У щенков до месячного возраста уровень мочевины в крови несколько выше референсных значений, у щенков старше 2-3 месяцев уровень мочевины становится немного ниже референсных значений в результате быстрого роста животных и увеличения интенсивности анаболических процессов. Повышение уровня мочевины в крови, наряду со снижением СКФ и возрастанием уровня креатинина, обуславливает развитие азотемии. Причины, вызывающие азотемию, могут быть преренальные, ренальные и постренальные. Преренальная азотемия развивается в результате гиповолемии. Ренальная азотемия возникает при поражении клубочкового аппарата почек, канальцевой системы, интерстициальной ткани почек, почечной лоханки или кровеносных сосудов. Постренальная азотемия возникает из-за обструкции в любой части мочевыводящей системы ниже нефрона или в результате разрыва мочевыводящих путей. Азотемия всегда сопоставляется со значением удельного веса мочи (относительной плотности мочи) и уровнем диуреза (анурия, олигурия или полиурия). При преренальной азотемии, как правило, отмечается высокая относительная плотность мочи (исключение могут составлять кошки некоторых пород). Азотемия при выявлении слабоконцентрированной мочи обычно имеет почечное происхождение. При постренальной азотемии моча имеет различную концентрацию, и ее диагностика зависит от определения уровня диуреза (выявление обструкции или разрыва мочевыводящих путей). Концентрация мочевины и креатинина в сыворотке крови не позволяет выявить причину азотемии. Для определения типа азотемии часто используют расчет индекса отношения азота мочевины к креатинину в сыворотке крови. Это отношение у мелких домашних животных составляет примерно 20:1 и у крупных животных ‒ 10:1. Повышение коэффициента может быть связано с обезвоживанием или кишечным кровотечением, тогда как понижение коэффициента связано с увеличением диуреза, наличием некреатининовых хромогенов или уникальной способностью крупного рогатого скота и лошадей к метаболизму и экскреции азота мочевины через желудочно-кишечный тракт. При желудочно-кишечном кровотечении возрастает уровень азота мочевины без увеличения уровня креатинина. Кровь в желудочно-кишечном тракте расщепляется, образующиеся аминокислоты и аммиак абсорбируются и током крови доставляются в печень, где превращаются в мочевину, которая выводится почками. Даже незначительное кишечное кровотечение может привести к развитию анемии, и для подтверждения требуется проведение исследования на скрытую кровь в фекалиях.
Повышение уровня:
Преренальные причины: • Дегидратация, гиповолемия, шок. • Потеря крови. • Ожоги. • Снижение сердечного выброса. • Сепсис. Ренальные причины: • Хроническая почечная недостаточность. • Острый тубулярный некроз вследствие ишемии, действия нефротоксинов, тяжелого внутрисосудистого гемолиза или миоглобинурии. • Гломерулонефрит. • Пиелонефрит (в т. ч. вызванный лептоспирозом). Постренальные причины: • Обструкции мочевыводящих путей. • Разрыв мочевыводящих путей. Желудочно-кишечное кровотечение. Высокобелковая диета. Повышение катаболизма белка в результате лихорадки или некроза тканей.
Понижение уровня:
Печеночная недостаточность. Полиурия-полидипсия не почечного происхождения (в т. ч. при применении глюкокортикоидных препаратов). Значительная потеря белка с мочой или через желудочно-кишечный тракт. Асцит. Снижение потребления белка или голодание. Гипергидратация.
Читайте также: