Телязиоз лечение у кошек
Опубликовано: 13.05.2024
Телязиоз (син.: Thelaziasis, Thelaziose) вызывается гельминтом из рода круглых червей — нематод — Thelazia Callipaeda, известным также и под другими названиями: глазной червь, Thelazia californiensis, Filaria circumoculariis, F. lacrimalis.
Гельминт впервые был идентифицирован в Индии в глазах собак. Эти, как их называли тогда, глазные черви часто встречаются у собак, лошадей, кошек и других животных в юго-восточной Азии, главным образом в Китае, Индии, Южной Корее, Бирме, а также в Калифорнии (США). Тслязии заносятся мухой из семейства Muscidae в слезную жидкость животных, а иногда и в копъюнктивальную полость человека. Гельминт нитевидный, круглый, длина самки 14—15 мм, самца 9—10 мм.
Обычно гельминты обитают у животных в слезных железах и слезных путях, откуда они могут проникнуть в конъюнктивальный мешок и вызвать воспалительную реакцию, нередко достаточно выраженную.
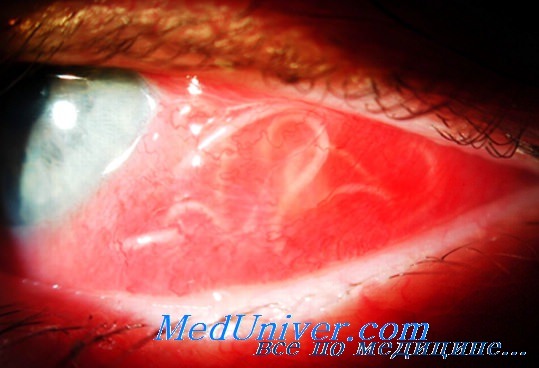
Поражение глаз при телязиозе
R. Knicrem и М. К. Jack наблюдали такой случай, когда отмечались длительное течение заболевания, наличие паразита Т. californiensis в нижнем конъюнктивальной своде и выраженная папиллярная реакция конъюнктивы. Авторы предположили, что больной заразился примерно год назад, когда он находился в Северной Калифорнии, в местности, где было много пораженных ланей. Называются и другие животные в Калифорнии, у которых наблюдаются поражения глаз: собаки, кошки, черный медведь, овцы, койоты, шакалы, лисицы.
Клиническая картина поражения глаз при телязиозе у людей во всех описанных в Калифорнии случаях была схожей: отмечался выраженный конъюнктивит, а при обследовании обнаруживался гельминт, иногда два. Обычно больные отмечали контакт мухи или комара с глазом за 1—2 мес до начала заболевания.
Яйца мухи или комара откладываются в слезных путях или конъюнктивальном мешке и жизненный цикл их может продолжаться [Schultz G. R.]. Предполагают, что в очень редких случаях гельминт может проникнуть в переднюю камеру и вызвать тяжелый иридоциклит с выраженным раздражением глаза [Schultz G. R.].
Диагностика телязиоза. Главными в диагностике являются эпидемиологический анамнез, клиническая картина заболевания, обнаружение и идентификация гельминта. Выявляются изменения крови, характерные для многих паразитарных заболеваниях: гиперлейкоцитоз и гиперэозинофилия.
Лечение телязиоза. Инсталляция глазных капель атропина и кортикостероидов уменьшает воспалительную реакцию. Следует иметь в виду, что при длительном применении атропина гельминт может погибнуть и вызвать сильную воспалительную реакцию [Schultz G. R.].
При обнаружении гельминта в конъюнктивальном мешке, слезных путях, конъюнктиве, роговице или передней камере его необходимо удалить, используя соответствующий хирургический подход. В послеоперационном периоде назначают диэтилкарбамазин для уничтожения микрофилярий по 50 мг 3 раза в течение 2 нед.
Кроме описанных, можно назвать еще два гельминта, которые обычно паразитируют у животных, но иногда, хотя и редко, могут быть причиной глазной патологии у человека. Нематода F. habronema — спиралевидная круглая филярия — паразитирует у лошадей, вызывая так называемый габронемический офтальмомиаз [Duke-Elder S.]. Заболевание известно в Австралии и передается мухой Musca doinestica.
Еще в 1922 г. L. Bull высказал предположение, что с этим гельминтом может быть связано состояние, известное среди аборигенов Австралии под названием «голубой глаз», характеризующееся голубоватым цветом век. Под конъюнктивой обнаруживают гранулематозную опухоль, содержащую паразита, окруженного эпдотелиальной клеточной инфильтрацией и необычными клетками с желтой пигментацией.
Еще реже встречаются и менее изучены поражения глаз, вызываемые интестинальной нематодой Oxyuris Vermicularis, близкой к Thelazia [Larwaviae A.]. Попавший в конъюнктивальный мешок возбудитель вызывает периодическое раздражение глаза с выраженной гиперемией конъюнктивы нижнего свода. В дальнейшем может образоваться гранулема века или развиться кератит [Africa С, Garcia Е., Kalyanaraman S., Ray F.]. Случай кератоконъюнктивита описан при общем поражении этим гельминтом [Богатова А. И.].
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Екатерина Васильева,
ветеринарный врач-офтальмолог, Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург
Введение
Телязиоз — это паразитарное заболевание глаз, вызванное нематодой Thelazia callipaeda (Spirurida, Thelaziidae), которая обитает в конъюнктивальном мешке различных видов животных (в основном плотоядных) и людей [1, 2].
Переносчиком гельминта является муха Phortica variegata (Diptera, Drosophilidae, Steganinae), которая, питаясь содержимым конъюнктивального мешка больного животного, заглатывает личинок Th. callipaeda первой стадии. В организме мухи личинки созревают до третьей инвазионной стадии и высвобождаются во время питания насекомого в конъюнктивальный мешок нового хозяина (со слизью и слёзной жидкостью), где они развиваются в половозрелых самцов и самок [2].
Клинические признаки телязиоза включают в себя конъюнктивит, слизисто-гнойные истечения из конъюнктивального мешка, блефарит, эпифору, кератит и в осложнённых случаях язву роговицы.
Диагноз ставится на основании прямой визуализации гельминтов в конъюнктивальном мешке животных (длина взрослых гельминтов от 8 мм до 2 см). Крупные породы собак, в основном живущие на открытом воздухе, чаще подвергаются заражению телязиозом [1].
Для лечения телязиоза у собак используются системные и местные препараты, содержащие ивермектин, мильбемицин, моксидектин [6–8].
Thelazia callipaeda распространена в Азии и Восточной Европе, также есть информация о клинических случаях в некоторых европейских странах: Франции, Германии, Бельгии, Швейцарии, Испании, Португалии [3], Румынии [4]. В России телязиоз описан у диких видов плотоядных животных в Приморском крае [5].
Клинический случай
В офтальмологическое отделение Ветеринарной клиники неврологии, травматологии и интенсивной терапии (Санкт-Петербург, Россия) поступила собака породы американский питбультерьер, сука, возраст 1 год, с длительными (около месяца) слизистыми выделениями из обоих глаз, блефароспазмом и зудом в области глаз.
Общее обследование не выявило признаков системных заболеваний. При офтальмологическом обследовании обнаружили гиперемию конъюнктивы, слизистые выделения из конъюнктивального мешка, при биомикроскопии (PSL, Reichert, США) — выраженный дистихиаз на верхнем и нижнем веке обоих глаз, флюоресцеиновый тест (Biovision Limited, Dunstable, Великобритания) был отрицательным в обоих глазах. Внутриглазное давление измеряли тонометром Tonovet (Icare, Финляндия), данные тонометрии находились в нормальных пределах (14 мм рт. ст. OD, 15 мм рт. ст. OS). Осмотр глазного дна проводился непрямым офтальмоскопом (Omega-180, Heine Optotechnik, Herrsching, Германия), патологических изменений не было обнаружено. Осмотр конъюнктивального мешка и внутренней поверхности третьего века с использованием местного обезболивания не проводился из-за крайне возбудимого темперамента животного. На основании данных осмотра был диагностирован конъюнктивит, предполагаемой причиной которого были неправильно растущие ресницы (дистихиаз).
 |  |
| Фото 1 . Телязия в конъюнктивальном мешке | Фото 2. Извлечение телязии пинцетом |
 |
| Фото 3. Извлечённые телязии |
Криодеструкция дистихиаза была выполнена в день первичного обращения. Процедуру выполняли с использованием общей анестезии: пропофол 6 мг/кг внутривенно (Propofol Fresenius Kabi, Fresenius Kabi Austria, Graz, Австрия), изофлуран 2% об. ингаляционно (Isofluran CP, CP-Pharma, Burgdorf, Германия), фентанил 0,2 мкг/кг внутривенно (Fentanyl-Janssen, Janssen Pharmaceutica, Beerse, Бельгия), конъюнктивальный мешок предварительно промывали 0,2-процентным раствором повидон йода (Бетадин, Будапешт, Венгрия). Фокальная криодеструкция фолликулов патологических ресниц выполнялась с использованием криозонда и жидкого азота (CryoStick, CryoTech, Москва, Россия) с увеличением при помощи хирургического микроскопа (Takagi OM8, Takagi Ophthalmic Instruments Europe LTD, Великобритания). После криодеструкции патологические ресницы были механически эпилированы пинцетом.
Во время процедуры криодеструкции на поверхности роговицы был замечен белый гельминт, он был подвижен и передвигался в глубь конъюнктивального мешка. При детальном обследовании конъюнктивального мешка был обнаружен ещё один гельминт и ещё два гельминта в конъюнктивальном мешке соседнего глаза (фото 1). Носослёзные каналы были промыты стерильным физиологическим раствором, во время промывания гельминтов не было обнаружено. Паразиты были извлечены и морфологически идентифицированы как Thelazia callipaeda, что также было подтверждено анализом, проведённым на кафедре паразитологии СПбГАВМ (фото 2 и 3). Заражение такими гельминтами не описано в Санкт-Петербурге, поэтому была собрана история перемещений животного, и владелец сообщил о поездке с собакой в Геленджик (Черноморское побережье, Краснодарский край, Россия) за два месяца до посещения клиники.
Таким образом установили диагноз «телязиоз», и для лечения использовали мильбемицина оксим перорально (0,5 мг/кг, Milbemax, Novartis, Bazel, Швейцария), дважды с интервалом 14 дней, и глазные капли с хлорамфениколом три раза в день в оба глаза в течение 10 дней (0,25%, Levomycetin, Lekko, Владимир, Россия). Через две недели после первоначального обследования и начала лечения клинические признаки конъюнктивита и патологические ресницы отсутствовали, а в конъюнктивальном мешке не было обнаружено гельминтов.
Обсуждение
По данным автора, это первый случай телязиоза у собаки в Санкт-Петербурге, с описанием его клинического проявления и результатов лечения. Обнаружение телязий может быть затруднительным без увеличения, а также при малом количестве паразитов, однако увеличение яркости света способствует движению паразитов, что улучшает их обнаружение. В описанном случае гельминты были обнаружены во время ревизии конъюнктивального мешка с использованием общей анестезии, что можно объяснить очень возбуждённым поведением собаки во время биомикроскопии, проводившейся без седации и общей анестезии, и небольшим количеством паразитов (по два в каждом глазу).
Лечение телязиоза у собак включает удаление паразитов пинцетом после инстилляции местного анестетика в конъюнктивальный мешок [3]. А также подкожные инъекции ивермектина, инстилляции моксидектина в конъюнктивальный мешок и накожное применение имидаклоприда в комбинации с моксидектином или селамектином, пероральное применение мильбемицина оксима [6–8]. В описанном случае выбор лечения в пользу перорального мильбемицина оксима был продиктован удобством использования владельцем, доступностью препарата в аптеках и его безопасностью.
Профилактические меры по литературным данным включают в себя ежемесячное пероральное применение мильбемицина оксима [3].
Телязиоз у человека широко распространён в Китае и Юго-Восточной Азии [2], и даже отмечено несколько случаев внутриглазной (внутривитреальной) локализации телязий, зарегистрированых в Китае [9–11]. За последние 10 лет в Европе было описано несколько случаев телязиоза у человека: во Франции, Италии [2] и Испании [12], в этих же странах был зарегистрирован и телязиоз собак. В Российской Федерации было описано всего два случая телязиоза у человека: в Хабаровском крае и во Владивостоке, несмотря на широкое распространение его среди диких плотоядных в этом регионе [5].
Данные о возникновении телязиоза среди людей в Краснодарском крае не были получены автором, однако свидетельства коллег — ветеринарных врачей о высокой частоте его встречаемости и случаи привозного из данной местности телязиоза у собак и кошек в Москве [13, 14] и Санкт-Петербурге вызывают настороженность относительно благополучия не только эпизоотологической, но и эпидемиологической обстановки.
Выводы
Наши данные свидетельствуют о том, что телязиоз следует включать в список дифференциальных диагнозов при офтальмологических патологиях у собак с предыдущей историей путешествий в Краснодарский край, а также в другие эндемичные районы. Мильбемицина оксим показал хорошую терапевтическую эффективность в описываемом случае, он удобен в применении и хорошо переносится пациентом. Профилактическая дегельминтизация соответствующими препаратами должна проводиться для всех собак, выезжающих в эндемичные районы, и для собак, постоянно живущих в этих районах.
Список литературы
- Otranto D, Traversa D. Thelazia eyeworm: an original endo- and ectoparasitic nematode. Trends in Parasitology 2005; 21: 1–4.
- Otranto D, Eberhard ML. Zoonotic helminths affecting the human eye. Parasites & Vectors 2011; 4: 41.
- Pimenta P, Cardosa L, Pereira M et al. Canine ocular thelaziosis caused by Thelazia callipaeda in Portugal. Veterinary Ophthalmology 2012; 16:4: 312–315.
- Mihalca AD, Ionica AM, D’Amico G et al. Thelazia callipaeda in wild carnivores from Romania: new host and geographical records. Parasites & Vectors 2016; 9:350.
- Хрусталёв А., Шайтанов В., Середкин И. Новые данные о распространении Thelazia callipaeda на Дальнем Востоке. Медицинская паразитология и паразитарные болезни 2015; 1:46–48.
- Bianciardi P, Otranto D. Treatment of dog thelaziosis caused by Thelazia callipaeda (Spirurida, Thelaziidae) using a topical formulation of imidacloprid 10% and moxidectin 2.5%. Veterinary Parasitology 2005; 129: 89–93.
- Ferroglio E, Rossi L, Tomio E et al. Therapeutic and prophylactic efficacy of milbemycin oxime (interceptor) against Thelazia callipaeda in naturally exposed dogs. Veterinary Parasitology 2008; 154: 351–353.
- Motta B, Schnyder M, Basano FS et al. Therapeutic efficacy of milbemycin oxime/praziquantel oral formulation (Milbemax) against Thelazia callipaeda in naturally infested dogs and cats. Parasites & Vectors 2012; 5:85.
- Zakir R, Zhong-Xia Z, Chioddini P et al. Intraocular infestation with the worm, Thelazia callipaeda. British Journal of Ophthalmology 1999; 83: 1194–1195.
- Xue C, Nong T, Zhenping H. Thelazia callipaeda in human vitreous. Canadian Journal of Ophthalmology 2007; 42: 883–884.
- Chen W, Zhong J, Hour P et al. A case of intraocular thelaziosis with rhegmatogenous retinal detachment. Clinical and Experimental Optometry 2010; 93:5: 360–362.
- Fuentes I, Montes I, Saugar G et al. Thelaziosis in humans, a zoonotic infection, Spain. Emerging infectious diseases 2012; 18:12: 2013–2075.
- Давыдова О., Шемяков Д. О некоторых особенностях лечения и диагностики редко встречающихся на территории Московского региона гельминтозов мелких домашних животных. Сборник статей девятой Всероссийской научно-практической конференции 2015; 49–50.
- Есаулова Н., Сароян С., Шемякова С. Телязиоз у собак (случай обнаружения в Московском регионе). Российский ветеринарный журнал 2017; 2: 16–17.

Лидокаин это эффективное обезболивающее средство. Местные анестезирующие средства угнетают ионные потоки, участвующие в образовании раздражителя, за счет чего и достигается обезболивающий эффект. Лидокаин стабилизирует нейронные мембраны, подавляет нервную проводимость, сокращает степень деполяризации.
Когда показан Лидокаин?
В спектр показаний раствора Лидокаина входят следующие условия:
Местное обезболивание, требуемое для проведения манипуляций в офтальмологии, ЛОР-практике, стоматологии, при хирургическом вмешательстве.
Применение в качестве растворителя антибактериальных препаратов группы цефалоспоринов, введение которых характеризуется выраженным болевым эффектом.
Лидокаин для инъекций позволяет на несколько часов обезболить необходимый участок кожи или слизистой, чего будет достаточно для проведения врачебной манипуляции, сопровождаемой повышенной чувствительностью.
Как применяется раствор Лидокаина?
Раствор местного анестетика предварительно тестируется на отдельном участке кожи, что позволяет оценить наличие или отсутствие индивидуальной негативной реакции на препарат.
Дозировка раствора Лидокаина зависит от типа анестезии:
Терминальный тип анестезии подразумевает местное нанесение раствора (2мг на кг веса), максимум 20 мл для взрослого пациента. Длительность эффекта составляет не более 30 минут.
Проводниковый тип анестезии. Дозировка зависит от масштабности участка, который необходимо обезболить. Максимальная доза 20 мл.
В офтальмологии раствор закапывается в конъюнктивальный мешок.
Эпидуральная анестезия – 22-30 мл раствора.
Обезболивание в акушерстве и гинекологии – 20-30 мл раствора.
В детском возрасте дозировка определяется в индивидуальном порядке (в среднем 3,5-4мг на кг веса).
Для предотвращения развития побочных эффектов раствор необходимо вводить строго в рекомендованных дозировках. Медикамент Лидокаин, инструкция по применению к которому содержит все необходимые дозировки, необходимо назначать после детального изучения анамнеза.
Побочные реакции
При неправильном применении возможно возникновение побочных реакций:
Головокружение, сонливость, судороги, нарушение чувствительности.
Изменения АД, нарушение сердечной деятельности.
Ощущение жара, отечность в месте укола.
Чувство жжения, тромбофлебит.
Перечень побочных реакций значительно шире, поэтому необходимо осуществлять контроль за состоянием пациента после введения раствора Лидокаина.
Противопоказания к применению раствора Лидокаин
Применение лекарственного препарата запрещено у пациентов с индивидуальной непереносимостью действующего вещества. Также Лидокаин уколы запрещены для применения при следующих состояниях:
Первые несколько месяцев после инфаркта миокарда.
Тяжелые сердечные патологии с брадикардией.
Инфекционный процесс в месте инъекции.
Период беременности, лактации.
Детский возраст (до 15 лет).
Судороги на фоне эпилепсии.
При указанных состояниях применять раствор Лидокаина не рекомендуется.
Взаимодействие раствора с другими препаратами
Лидокаин одновременно не рекомендуется сочетать со следующими группами препаратов:
Анальгетики наркотической группы – грозит угнетением дыхания.
Антикоагулянты – повышается риск кровотечений.
Сердечные гликозиды – уменьшается их эффективность.
Новокаиновая группа – повышается миорелаксация.
Эталон – негативный эффект на дыхательную функцию.
Раствор Лидокаина следует с особой осторожностью сочетать при заболеваниях сердца и нервной системы, сопровождающихся систематическим приемом препаратов.
Особые указания
Инъекционное введение Лидокаина должно производиться только под контролем врача. Лечение должно производиться под ЭКГ-контролем.
Перед началом лечения рекомендуется исследовать уровень калия в крови, так как при сниженном его содержании эффективность препарата снижается.
Лекарственное средство оказывает воздействие на ЦНС, поэтому не рекомендуется в период его применения садиться за руль или заниматься деятельностью с возможной угрозой для жизни.
Тщательное наблюдение требуется за пациентами со склонностью к судорогам, так как даже незначительные дозы могут усиливать судорожный эффект.
Необходимо с осторожностью комбинировать Лидокаин с теми препаратами, которые усиливают его биодоступность, либо замедляют его выведение, что может быть особенно опасным при почечной недостаточности в терминальной стадии.
При внутримышечном введении раствора Лидокаин может наблюдаться повышенная активность креатинфосфокиназы, что препятствует постановке диагноза инфаркт миокарда.
Быстрое введение раствора Лидокаина может привести к резкому снижению артериального давления, с возможностью развития коллапса. В данном случае следует рассматривать и токсическое действие лекарственного средства с оказанием кардиотоксического действия.
Раствор Лидокаина: применение у детей
Препарат запрещен для применения в младенческом возрасте, так как он может оказать токсическое действие и спровоцировать возникновение судорог, аритмии.
У детей до 12 лет препарат вводится с осторожностью и в небольших дозах, так как он может накапливаться и впоследствии приводить к негативным последствиям.
Местное анестезирующее средство рекомендуется для применения со строгим соблюдением рекомендаций, указанных в Лидокаин ампулы инструкции к препарату.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Авторизуйтесьчтобы оставлять комментарии
Возрастные ограничения 18+
| Название | Форма выпуска | Владелец рег/уд |
АВЕРСЕКТ ® К&С  |
Лечение и профилактика у собак и кошек:
- нематодозов;
- демодекоза;
- отодектоза;
- нотоэдроза;
- саркоптоза;
- энтомозов, вызванных блохами, вшами или власоедами.
Лечение и профилактика у собак и кошек:
- нематодозов;
- демодекоза;
- отодектоза;
- нотоэдроза;
- саркоптоза;
- энтомозов, вызванных блохами, вшами или власоедами.
С лечебной и профилактической целью крупному рогатому скоту, овцам, козам, свиньям, северным оленям, маралам, лосям и верблюдам при:
- оводовых инвазиях;
- нематодозах ЖКТ и легких;
- псороптозе;
- хориоптозе;
- саркоптозе;
- сифункулятозах.
С лечебной и профилактической целью крупному рогатому скоту при:
- гиподерматозе;
- нематодозах;
- псороптозе;
- хориоптозе;
- саркоптозе;
- сифункулятозах;
- поражении иксодовыми клещами.
Для дегельминтизации лошадей при:
- нематодозах (включая делафондиоз, альфортиоз, трихонематозы, параскаридоз, оксиуроз, стронгилез, стронгилоидоз, парафиляриоз, сетариоз, габронематоз, драйшиоз);
- цестодозах (аноплоцефалидозы);
- ассоциативных инвазиях (полиинвазиях), вызванных
нематодами, цестодами и личинками оводов.
Назначают взрослым собакам и кошкам, щенкам и котятам старше 2-месячного возраста с целью лечения и профилактики:
- кишечных нематодозов;
- цестодозов;
- энтомозов;
- отодектоза;
- саркоптоза;
- нотоэдроза;
- демодекоза.
- крупному рогатому скоту и овцам при диктиокаулезе, остертагиозе, гемонхозе, трихостронгилезе, коопериозе, хабертиозе, протостронгилезе, эзофагостомозе, нематодирозе, буностомозе, стронгилоидозе, сифункулятозах, оводовых инвазиях, псороптозе и хориоптозе;
- свиньям при аскаридозе, эзофагостомозе, трихоцефалезе, стронгилоидозе, метастронгилезе, саркоптозе и гематопинозе.
- лечение и профилактика нематодозов и арахноэнтомозов.
Крупному рогатому скоту, овцам и оленям при:
- диктиокаулезе;
- остертагиозе;
- гемонхозе;
- трихостронгилезе;
- коопериозе;
- хабертиозе;
- протостронгилезе;
- эзофагостомозе;
- нематодирозе;
- буностомозе;
- стронгилоидозе;
- телязиозе;
- сифункулятозах;
- гиподерматозе;
- эстрозе;
- эдемагенозе;
- цефеномиозе;
- псороптозе;
- саркоптозе;
- хориоптозе.
- аскаридозе;
- эзофагостомозе;
- трихоцефалезе;
- стронгилоидозе;
- метастронгилезе;
- саркоптозе;
- гематопинозе.
С лечебно-профилактической целью при арахно-энтомозах и нематодозах:
- крупному рогатому скоту при стронгилятозах, трихоцефалезе, стронгилоидозе, телязиозе, сифункулятозах, гиподерматозе, псороптозе; саркоптозе и хориоптозе;
- овцам и козам при диктиокаулезе, протостронгилезе, мюллериозе, гемонхозе, остертагиозе, нематодирозе, маршаллагиозе, коопериозе, хабертиозе, эзофагостомозе, буностомозе, трихоцефалезе, стронгилоидозе, мелофагозе, эстрозе, псороптозе и хабертиозе;
- оленям при диктиокаулезе, остертагиозе, нематодирозе, стронгилоидозе, трихоцефалезе, эдемагенозе, цефеномиозе и саркоптозе;
- верблюдам при диктиокаулезе, остертагиозе, нематодирозе, стронгилоидозе, трихоцефалезе и саркоптозе;
- свиньям при трихоцефалезе, аскаридозе, метастронгилезе, эзофагостамозе, стронгилоидозе, стефанурозе, гематопинозе и саркоптозе.
С лечебно-профилактической целью при арахноэнтомозах и нематодозах:
- крупному рогатому скоту при стронгилятозах, трихоцефалезе, стронгилоидозе, телязиозе, сифункулятозах, гиподерматозе, псороптозе, саркоптозе и хориоптозе;
- овцам и козам при диктиокаулезе, протостронгилезе, мюллериозе, гемонхозе, остертагиозе, нематодирозе, маршаллагиозе, коопериозе, хабертиозе, эзофагостомозе, буностомозе, трихоцефалезе, стронгилоидозе, мелофагозе, эстрозе, псороптозе и хабертиозе;
- оленям при диктиокаулезе, остертагиозе, нематодирозе, стронгилоидозе, трихоцефалезе, эдемагенозе, цефеномиозе и саркоптозе;
- верблюдам при при диктиокаулезе, остертагиозе, нематодирозе, стронгилоидозе, трихоцефалезе и саркоптозе;
- свиньям при трихоцефалезе, аскаридозе, метастронгилезе, эзофагостамозе, стронгилоидозе, стефанурозе, гематопинозе и саркоптозе;
- курам (цыплятам-бройлерам, племенной птице, ремонтному молодняку и птице в период линьки) при аскаридиозе, гетеракидозе, капилляриозе, энтомозах, вызванных Dermatoryktes mutans, Aphaniptera spp., Menacanthus stramineus, Ceratophyllus gallinae, акарозах, вызванных Dermanyssus gallinae, Knemidocoptes mutans, Menopon gallinae.
Курам (цыплятам-бройлерам, племенной птице, ремонтному молодняку и птице в период линьки) с лечебно-профилактической целью при арахноэнтомозах и нематодозах в т.ч. при:
- аскаридиозе;
- гетеракидозе;
- капилляриозе;
- энтомозах, вызванных Aphaniptera spp., Menacanthus stramineus, Ceratophyllus gallinae, Menopon gallinae;
- акарозах, вызванных Dermanyssus gallinae, Knemidocoptes mutans, Dermatoryktes mutans.
Собакам и кошкам:
- для лечения и профилактики энтомозов,
отодектоза, кишечных нематодозов (токсокароз, унцинариоз, анкилостомоз); - в целях профилактики дирофиляриоза.
- для лечения и профилактики саркоптоза, демодекоза, поражении иксодовыми клещами.
- для лечения и профилактики нотоэдроза.
Собакам и кошкам:
- для лечения и профилактики энтомозов,
отодектоза, кишечных нематодозов (токсокароз, унцинариоз, анкилостомоз); - в целях профилактики дирофиляриоза.
- для лечения и профилактики саркоптоза, демодекоза, поражении иксодовыми клещами.
- для лечения и профилактики нотоэдроза.
С лечебной и профилактической целью:
- крупному рогатому скоту - при гемонхозе, эзофагостомозе, буностомозе, трихостронгилезе, остертагиозе, фасциолезе и гиподерматозе;
- овцам и козам - при гемонхозе, нематодирозе, трихостронгилезе, хабертиозе, буностомозе, эзофагостомозе, фасциолезе и эстрозе.
Для лечения и профилактики заболеваний, вызываемых нематодами ЖКТ, легких, подкожной клетчатки, слезных протоков, личинками подкожных и носоглоточных оводов, личинками мух, блохами, вшами, чесоточными и иксодовыми клещами.
Крупному рогатому скоту применяют при заболеваниях, вызываемых:
- нематодами ЖКТ (половозрелые и личинки): Ostertagia ostertagi (включая инкапсулированные личинки), Ostertagia lyrata, Haemonchus placei, Haemonchus similis, Trichostrongylus axei, Trichostrongylus colubriformis, Trichostrongylus longispicularis, Mecistocirrus digitatus, Cooperia oncophora (включая инкапсулированные личинки), Cooperia pectinata, Cooperia punctata, Cooperia spatulata, Cooperia surnabada (синоним Mcmasteri), Nematodirus helvetianus, Nematodirus spathiger, Bunostomum phlebotomum, Strongyloides papillosus, Oesophagostomum radiatum, Trichocephalus discolor, Trichocephalus ovis;
- легочными нематодами (половозрелые и личинки) – Dictyocaulus viviparus;
- нематодами слезных протоков – Thelazia spp.;
- подкожными нематодами – Parafilaria bovicola;
- личинками подкожных оводов: Hypoderma bovis, Hypoderma lineatum;
- вшами: Haematopinus eurystomus, Linognathus vituli, Solenopotes capillatus;
- саркоптоидными клещами: Psoroptes bovis, Sarcoptes bovis, Chorioptes bovis;
- иксодовыми клещами – Boophilus microplus;
- аргасовыми клещами – Ornithodoros spp.
Овцам применяют при заболеваниях, вызываемых:
- нематодами ЖКТ: Ostertagia (Teladorsagia) circumcincta (половозрелые и личинки, включая резистентные к производным бензимидазола), Haemonchus contortus (половозрелые и личинки), Trichostrongylus axei (половозрелые и личинки), Trichostrongylus colubriformis (половозрелые и личинки), Trichostrongylus vitrinus (половозрелые и личинки), Cooperia curticei (личинки), Cooperia oncophora (половозрелые и личинки), Oesophagostomum venulosum (половозрелые), Nematodirus spp. (половозрелые и личинки), Strongyloides papillosus, Trichocephalus ovis;
- легочными нематодами – Dictyocaulus filaria;
- чесоточными клещами: Psoroptes ovis, Sarcoptes ovis;
- личинками носоглоточного овода – Oestrus ovis.
Свиньям применяют при заболеваниях, вызываемых:
- нематодами ЖКТ (взрослые и личинки): Hyostrongylus rubidus, Ascaris suum, Strongyloides ransomi (половозрелые), Oesophagostomum dentatum, Oesophagostomum quadrispinulatum, Trichocephalus suis;
- легочными нематодами (половозрелые) – Metastrongylus spp.;
- почечными нематодами (половозрелые) – Stephanurus dentatus;
- вшами – Haematopinus suis;
- чесоточными клещами – Sarcoptes scabiei.
Лечение и профилактика у лошадей:
- стронгилидозов;
- трихонематидозов (циатостоминозов);
- оксиуроза;
- пробстмауриоза;
- параскаридоза;
- стронгилоидоза;
- трихостронгилеза;
- диктиокаулеза;
- парафиляриоза;
- сетариоза;
- онхоцеркоза;
- габронематоза;
- драйшиоза;
- гастрофилеза;
- ринэстроза.
Крупному рогатому скоту, овцам, козам, оленям и верблюдам:
- при нематодозах: диктиокаулез, трихостронгилятозы, стронгилоидоз, аскаридатозы, буностомоз, телязиоз;
- при гиподерматозе, эстрозе, псороптозе, саркоптозе, сифункулятозе, маллофагозе;
- для борьбы с падальными и мясными мухами.
- при стронгилятозах, параскаридозе, оксиурозе, саркоптозе и гастрофилезе.
- при аскаридозе, эзофагостомозе, трихоцефалезе, стронгилоидозе, стефанурозе, метастронгилезе и других нематодозах;
- при саркоптозе и вшивости.
Собакам и кошкам:
- при токсокарозе и токсаскаридозе, анкилостомозе и унцинариозе, саркоптозе и отодектозе, демодекозе и поражении блохами.
В статье приведён ретроспективный анализ клинического случая применения Фелиферона кошке, инфицированной вирусной лейкемией кошек. Эффективность оценивалась по данным определения количественной РНК ВЛК методом ПЦР, динамики ОАК, БАК.
Отмечено снижение количества РНК вируса лейкемии кошек до неопределяемого уровня. Негативных последствий применения Фелиферона не выявлено.
Введение
С развитием возможностей лабораторной диагностики все больше возникает интерес к ретровирусным инфекциям кошек, наиболее распространенными из которых являются вирусная лейкемия (ВЛК) и вирусный иммунодефицит (ВИК). Возбудители относятся к разным родам: ВИК – к роду лентивирусов, ВЛК принадлежит к роду гаммаретровирусов [1].
Распространенность ВЛК в популяции домашних кошек Москвы и МО в 2011 г. составляла 11,9%. По состоянию на 2015 г. процент распространения возрос до 20,7%. Данные относятся к кошкам, по какой-либо причине поступавшим на приём в ветеринарные клиники Москвы и МО [2].
Смертность инфицированных ВЛК кошек в домашних хозяйствах с несколькими кошками в первые два года с момента инфицирования оценивается примерно в 50%, за первые три года с момента инфицирования – в 80% [3, 4]. При улучшении условий содержания (в том числе исключении стресса), с переводом на одиночное содержание, продолжительность жизни кошек увеличивается и напрямую зависит от сохранения благоприятной обстановки внешней среды [8].
Мониторинг нуклеиновых кислот кошачьих ретровирусов в периферической крови кошек в настоящее время всё больше используется с прогностической целью. Считается, что обнаружение провирусной ДНК ВЛК на протяжении длительного времени у кошки позволяет судить о прогрессировании инфекции [1, 3–5]. Все больший интерес вызывает определение вирусной РНК в периферической крови кошек как более объективного показателя течения ВЛК-инфекции [6].
В данной статье рассмотрен клинический случай применения Фелиферона у кошки, инфицированной ВЛК. В качестве основного критерия эффективности использована ПЦР РВ с определением количества РНК ВЛК до и после применения препарата.
Эффективность Фелиферона при ВЛК установлена в клиническом исследовании, организованном НТЦ «БиоИнвест» в 2016–2017 г. [7].
Клинический случай
Кошка, 10 месяцев, мейнкун, попала под наблюдение 1 июля 2017 г. с симптомами акне, изменением слизистой оболочки десны. Внешних паразитов не обнаружено, дегельминтизация проведена в течение полугода до обращения. Вес 4,3 кг, упитанность средняя. Препаратов этиотропной терапии вирусных заболеваний животному не применялось.
Из анамнеза заболевания: медленно прогрессирующее акне, медленно прогрессирующий гингивостоматит неуточнённый, коричневый налет на поверхности ушных раковин, коричневые корочки в углах глаз. Т, П, ЧДД в норме, л/у не выражены, слизистые оболочки в норме, СНК 1 с. Грудная, брюшная полость без признаков патологий. Угнетения, дегидратации не выявлено. Аппетит сохранен. Естественные отправления в норме.
Из анамнеза жизни: квартирное, одиночное содержание. Кошка приобретена у заводчика, не стерилизована. Профилактические антипаразитарные обработки проводились по срокам, согласно общепринятым нормам, вакцинация от бешенства согласно нормативам, поливалентная вакцина – март 2016 г. Кормление сухим кормом.
Первичное обследование включало осмотр, общий и биохимический анализ крови, диагностику инфекционных болезней. По окончании курса Фелиферона – общий и биохимический анализ крови, количественное определение РНК ВЛК в периферической крови.
Вирусная нагрузка (ВН) – мера тяжести вирусной инфекции, которая рассчитывается путем оценки количества вирусных частиц в определенном объеме биологической жидкости зараженного организма [9].
По данным таблицы 1, вирусная нагрузка больной кошки составляет на момент входящего обследования 800 копий/мл и может оцениваться как низкая. Учитывая ко-инфекцию ВЛК, калицивируса и коронавируса, целесообразно применение Фелиферона для профилактики прогрессирования одной или сочетания обнаруженных инфекций в организме данной кошки.
Таблица 1. Карта результатов лабораторной диагностики инфекционных болезней (Ветеринарный лабораторный сервис «Зайцев+», г. Москва)
| Вид исследования | ВЛК | ВИК | КорВК | Калицивироз | Герпесвирусный ринотрахеит |
| ПЦР кач. | Положит. | Отрицат. | - | Положит. | Отрицат. |
| ИФА кач. | Отрицат. | Отрицат. | - | - | - |
| ПЦР колич. (копий/мл) | 800 | 3 /л). Динамика показателей ОАК коррелирует с результатами исследования по оценке эффективности Фелиферона при ВЛК 2016–2017 гг. |
Показатели первичного биохимического анализа крови выявили повышенные значения общего белка, глобулинов, щелочной фосфатазы. После окончания курса Фелиферона показатели биохимического анализа крови несколько улучшились.
На повторном приеме через 1 месяц от назначения Фелиферона объективно у данной кошки отмечалась нормализация упитанности, увеличение веса с 4,3 до 5,3 кг, улучшение габитуса, уменьшение площади поражения акне. Гинивит – без изменений. По поводу гингивита кошке назначен курс доксициклина.
Таблица 3. Динамика показателей общего анализа крови (ветеринарная лаборатория ИВЦ МВА им К.И. Скрябина)
| Показатель | Результаты входящего обследования | Результаты после применения Фелиферона | Норма (лаборатория ИВЦ МВА К.И. Скрябина) | Единицы измерения |
| Лейкоциты (WBC) | 10 | 8,5 | 5,5-18 | 10 9 /л |
| Эритроциты (RBC) | 7,64 | 7,35 | 6-9 | 10 12 /л |
| Гемоглобин (Hb, HGB) | 118 | 112 | 100-180 | Г/л |
| Средняя концентрация гемоглобина в эритроците (MCHC) | 314 | 331 | 300-380 | Г/л |
| Среднее содержание гемоглобина в эритроците (MCH) | 15,4 | 15,2 | 13–21 | Пг |
| Средний объем эритроцита (MCV) | 49,2 | 46 | 39-52 | Мкм 3 |
| Показатель анизоцитоза эритроцитов (RDW-CV) | 13,7 | 13,7 | 14-18 | % |
| Ширина распределения эритроцитов по объему(RDW-CD) | 36,9 | 31,8 | 35-56 | Мкм 3 |
| Гематокрит (Ht, HCT) | 37,6 | 33,8 | 32-50 | % |
| Тромбоциты (PLT) | 157 | 280 | 100-514 | 10 3 /л |
| Средний объем тромбоцита (MPV) | 9 | 8,9 | 5-9 | Мкм 3 |
| Ширина распределения тромбоцитов (PDW) | 16,4 | 15,1 | 10-18 | Мкм 3 |
| Тромбокрит (PCT) | 0,142 | 2,248 | 0,1-0,5 | % |
| Макротромбоциты (P-LCR) | 28,4 | 25 | 13-43 | % |
| Скорость (реакция) оседания эритроцитов (СОЭ, РОЭ, ESR) | 40 | 20 | 1-6 | Мм/ч |
| Базофилы | 1 | 0 | 0 | % |
| Эозинофилы | 5 | 2 | 0-5 | % |
| Юные нейтрофилы | 0 | 0 | 0-1 | % |
| Палочкоядерные нейтрофилы | 0 | 0 | 3-6 | % |
| Сегментоядерные нейтрофилы | 73 | 70 | 35-75 | % |
| Лимфоциты | 21 | 23 | 25-55 | % |
| Моноциты | 0 | 2 | 1-5 | % |
| Кровепаразиты | нет |
Обсуждение
Результаты наблюдения за кошкой в описанном клиническом случае коррелируют с таковыми в клиническом исследовании, организованном НТЦ «БиоИнвест» в 2016–2017 гг. [7]. Основное действие Фелиферона, в случае, если кошка больна ВЛК, направлено на снижение виремии.
Динамика показателей ОАК и БАК не нуждается в обсуждении, так как произошедшие изменения незначительны и вряд ли как-то напрямую могут быть связаны с применением Фелиферона, как в случае если бы речь шла о вирусном иммунодефиците кошек [10].
Таким образом, функция Фелиферона в терапии ВЛК определена как этиотропная.
Таблица 4. Динамика показателей биохимического анализа крови (ветеринарная лаборатория ИВЦ МВА им К.И. Скрябина)
| Показатель | Результаты входящего обследования | Результаты после применения Фелиферона | Норма (лаборатория ИВЦ МВА К.И. Скрябина) | Единицы измерения |
| Белок общий | 87,9 | 75,7 | 57-78 | Г/л |
| Альбумин | 32,6 | 33,6 | 29-39 | Г/л |
| Глобулин | 55,3 | 42,1 | 29-39 | Г/л |
| Глюкоза | 6,28 | 6,0 | 3,3-6,8 | Ммоль/л |
| Амилаза | 1004 | 1140 | 0-1600 | Ед/л |
| АСТ | 19 | 23 | 0-45 | Ед/л |
| АЛТ | 52 | 49 | 0-60 | Ед/л |
| Билирубин общий | 5,5 | 6,0 | 2-10 | Ммоль/л |
| Билирубин прямой | 5,1 | 4,3 | 0-5 | Ммоль/л |
| Мочевина | 8,53 | 8,32 | 5-15 | Ммоль/л |
| ЩФ | 188 | 95 | 10-90 | Ед/л |
| Холестерин | 2,8 | 3,5 | 0-6,5 | Ммоль/л |
| КФК | 108 | 143 | 15-350 | Ед/л |
| Кальций ионизированный | 1,18 | 1,3 | 1,1-1,4 | Ммоль/л |
| Калий | 4,43 | 4,0 | 3,6-5,5 | Ммоль/л |
| Натрий | 150,7 | 149 | 145-158 | Ммоль/л |
| Хлор | 112 | 114 | 107-129 | Ммоль/л |
Заключение
Фелиферон может применяться в комплексной терапии кошек с положительными лабораторными тестами, указывающими на репродукцию вируса лейкемии кошек в периферической крови (ПЦР).
Область применения Фелиферона в качестве этиотропного средства может распространяться на профилактику развития ВЛК-инфекции при наличии низкой ВН; для лечения кошек с прогрессированием ВЛК-инфекции, если клинический случай позволяет компенсировать нарушения работы организма, вызванные инфекцией, за счет еще имеющихся ресурсов.
Безусловно, кошки, больные ВЛК, нуждаются в комплексной терапии, направленной на восстановление и поддержание всего гомеостаза в целом.
Повторные курсы Фелиферона должны назначаться ветеринарным врачом на основании результатов очередного обследования по поводу течения ВЛК-инфекции.
Клинические исследования эффективности и безопасности Фелиферона при вирусе лейкемии кошек выполнены при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере, в рамках программы «Коммерциализация», Государственный контракт № 352ГКС4/16170 от 03.08.2015.
Литература
1. Hartmann K. Clinical Aspects of Feline Retroviruses: A Review. Viruses2012, 4, 2684-2710; doi:10.3390/ v4112684
2. Бажибина Е.Б. Мониторинг результатов лабораторных исследований кошек — носителей хронических вирусных инфекций. Российский ветеринарный журнал. 2016; 3: 6–8.
3. Cotter, S.M. Feline viral neoplasia. Infectious diseases of the dog and cat, 2nd ed.; Greene, C.E. Ed. WB Saunders: Philadelphia, 1998.
4. Levy J.K. FeLV and non-neoplastic FeLV-related disease. In Textbook of veterinary internal medicine. Eds. WB Saunders: Philadelphia, 2000.
5. Cattori V, Pepin AC at al. Real-time PCR investigation of feline leukemia virus proviral and viral RNA loads in leukocyte subsets. Vet. ImmunolImmunophatol. 2008 May 15; 123 (1-2):124-8. doi: 10.1016/j.vetimm.2008.01.018. Epub 2008 Jan 19.
6. Nesina S., KatrinHelfer-Hungerbuehler A. Retroviral DNA-the silent winner: blood transfusion containing latent feline leukemia provirus causes infection and disease in naive recipient cats.
7. Пархоменко С.А. Применение Фелиферона® в качестве средства этиотропной терапии при вирусной лейкемии кошек. Российский ветеринарный журнал. 2017; 5. — С.
8. Levy J.K., Scott H.M., Lachtara J.L., Crawford P.C. Seroprevalence of feline leukemia virus and feline immunodeficiency virus infection among cats in north America and risk factors for seropositivity. J AmVetMedAssoc. 2006; 228: 371–376.
9. https://ru.wikipedia.org/wiki/Вирусная_нарузка по состоянию на 21.09.2017.
10. Пархоменко С.А. Клинический случай вирусного иммунодефицита кошки. Ветфарма, 2017; № 4. — С.24-27
Читайте также:

