Чем повысить альбумин в крови собаки
Опубликовано: 07.05.2024
Срок исполнения
1 рабочий день (плюс 1-2 для регионов)
Исследуемый материал
Метод определения
С бромкрезоловым зеленым,фотометрия
Альбумин представляет собой небольшой глобулярный белок с молекулярной массой 66,4 кДа.
Синтезируется альбумин в гепатоцитах и обеспечивает приблизительно 75-80% онкотического давления плазмы.
Скорость синтеза альбумина регулируется коллоидно-осмотическим давлением и зависит от гормонов, таких как инсулин, тироксин и кортизол. Отличительной чертой первичной структуры альбумина является то, что он имеет нечетное число остатков цистеина (35 в общей сложности) и свободный цистеиновый остаток, что делает альбумин сильным антиоксидантом (акцептором реактивных кислородных радикалов). Альбумин составляет от 30 до 45% от общего протеина. После попадания в кровоток альбумин необратимо модифицируется путем неферментативного гликирования остатков лизина, так что от 6 до 10% альбумина представляют собой гликоальбумин ‒ продукт взаимодействия с глюкозой или галактозой. Катаболизм альбумина происходит в различных органах и тканях, где он проникает в клетки путем пиноцитоза со скоростью, зависящей от концентрации предсердного натрийуретического пептида, а затем подвергается протеасомальной деградации. От 40 до 60% от общего альбумина разрушаются в мышцах, печени и почках.
За счет отрицательного заряда молекул альбумин выполняет важную транспортную функцию, являясь белком-переносчиком для свободных жирных кислот, Ca2+, Mg2+, желчных кислот, неконъюгированного билирубина, тироксина и некоторых лекарственных препаратов. Период полувыведения альбумина варьируется в зависимости от вида животного и составляет от 1,9 дней у мышей до 19,4 дней у лошадей. Существует прямая корреляция между скоростью обмена альбумина и размерами тела. То есть крупные животные имеют низкую скорость метаболизма и, следовательно, более подвержены отекам, вызванным гипоальбуминемией, чем мелкие животные. Период полувыведения альбумина у собак составляет 8 дней.
Снижение концентрации альбумина ниже 10 г/л может привести к значительному уменьшению онкотического давления и перемещению жидкости из внутрисосудистого пространства в интерстициальную область. В результате развивается гипотония, образуются отеки (подкожные, отеки легких) и полостные выпоты (плеврит, асцит). С одновременным увеличением портальной гипертензии у животных может происходить образование полостных выпотов при более высоких значениях альбумина (более 15 г/л). У пациентов с тяжелой гипоальбуминемией может снижаться активность антитромбина III, что представляет опасность формирования тромбоэмболии легочных, мезентериальных и портальных сосудов.
Синтез альбумина заметно снижается в острую фазу воспалительного процесса («отрицательный» белок острой фазы). Его концентрация падает постепенно в период течения инфекционного заболевания и воспалительного процесса.
Увеличение концентрации альбумина, как правило, является результатом обезвоживания и гемоконцентрации. При повышении концентрации сывороточного альбумина в результате обезвоживания не наблюдается корреляции между гиперальбумиемией и заболеваниями почек. Однако дегидратация часто отмечается у пациентов с почечной недостаточностью. Различие между преренальной и почечной азотемией проводится путем измерения относительной плотности мочи при одновременной оценке тургора кожи, гематокрита и сывороточного альбумина.
Гипоальбуминемия может возникнуть в результате проникновения альбумина в клубочковый ультрафильтрат и предполагает поражение клубочков и хронический характер заболевания. В первичную мочу не попадают отрицательно заряженные молекулы, чья молекулярная масса превышает 68 кДа. При заболеваниях клубочкового аппарата почек фильтрационная мембрана почечного тельца теряет свой отрицательный заряд в результате осаждения иммуноглобулинов (положительно заряженных) на базальной мембране клубочков в патогенезе гломерулонефрита и амилоидоза. В результате альбумин может просачиваться в клубочковый ультрафильтрат благодаря небольшому размеру (66 кДа) и отрицательному заряду своих молекул. У здоровых животных небольшое количество альбумина проникает в ультрафильтрат, реабсорбируется в канальцах почек и подвергается деградации лизосомальными ферментами в эпителиальных клетках. Несмотря на то, что альбуминурия может быть связана с поражением канальцев, содержание белка в моче при этом незначительное, и этот механизм никогда не приводит к гипоальбуминемии.
При заболеваниях печени гипоальбуминемия не выявляется, пока не будут нарушены более 70% функции гепатобилиарной системы. Гипоальбуминемия часто сопровождается гиперглобулинемией, с некоторыми дополнениями:
- антигенная стимуляция может увеличить производство иммуноглобулина, маскируя потери глобулина;
- при заболеваниях почек уровень глобулина, как правило, остается нормальным, поскольку глобулины имеют слишком большие размеры, чтобы пройти через фильтрационный барьер клубочков, даже в случаях его повреждения;
- большинство сывороточных глобулинов синтезируются в печени, но в результате одновременного системного синтеза иммуноглобулинов у животных с заболеваниями гепатобилиарной системы часто определяются нормальные или даже повышенные концентрации глобулина.
Показания к назначению:
- Оценка состояния гидратации.
- Оценка состояния пациентов при анемиях, полостных выпотах, заболеваниях печени и почек, потере веса и/или отеках.
ПРЕАНАЛИТИКА
Для получения более точных результатов животные перед исследованием должны находиться на голодной диете не менее 12 часов. Образец стабилен 1 месяц при температуре хранения +2°С…+8°С; сохраняет стабильность более 1 месяца при замораживании -17ºС…-23ºС. Гемолиз или гемоглобинемия могут ложно завышать значения альбумина. Ложное занижение результата может возникать при выраженном хилезе (липемии) или гипертриглицеридемии.
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей, дополнительных сведений и зависит от методов диагностики.
Единицы измерения лаборатории VET UNION: г/л.
Референсные значения:
Собаки: 0-6 мес. ‒ 15-37 г/л; 6-12 мес. – 26-37 г/л; старше одного года – 25-37 г/л.
Кошки: 0-6 мес. ‒ 19-30 г/л; 6-12 мес. – 24-38 г/л; старше 1 года – 24-39 г/л.
Лошади: 27-42 г/л.
КРС: 27-43 г/л.
МРС: 24-43 г/л.
Хорьки: 26-38 г/л – альбиносы; 33-41 г/л – темные.
Леопард: 21-46 г/л.
Шиншилла: 23-41 г/л.
Тигр: 21-46 г/л.
Кролик:25-45 г/л.
Крыса:38-48 г/л.
Морская свинка: 21-39 г/л.
Мышь:25-48 г/л.
Песчанка:18-55 г/л.
Хомяк: 35-49 г/л.
Ацетилсалициловая кислота в повышенных дозах снижает уровень альбумина. Тестостерон, эстроген и гормон роста могут вызвать легкое увеличение концентрации альбумина в крови. Высокие дозы глюкокортикоидов способны привести к незначительному увеличению уровня альбумина. Длительное применение кортикостероидов в высоких дозах у собак может стать причиной гипопротеинемии и гипоальбуминемии, но значения возвращаются к нормальным в течение нескольких недель после прекращения терапии. Противосудорожные и противоопухолевые препараты у собак и кошек не вызывают гипоальбуминемию сами по себе, без соответствующих причин, лежащих в основе снижения альбумина (например, цирроз печени).
Повышение уровня:
Гемоконцентрация в результате дегидратации.
Понижение уровня:
Снижение синтеза (при печеночной недостаточности, синдроме мальабсорбции, экзокринной недостаточности поджелудочной железы, воспалении).
Потеря крови.
Потеря белка, связанная с нефропатией (иммуноопосредованным или врожденным гломерулонефритом, амилоидозом печени).
Потеря белка, связанная с энтеропатией (заболеваниями слизистой оболочки тонкого отдела кишечника, вызванными воспалительным процессом или неоплазией; кишечной лимфангиэктазией (идиопатической гипопротеинемией); желудочно-кишечными кровотечениями, в т. ч. вызванными гельминтозами).
Потеря белка, связанная с дерматопатией (ожогами, экссудативной формой генерализованного заболевания кожи).
Васкулит.
Чрезмерное внутривенное введение жидкости.
Гемодилюция, вызванная синдромом неадекватной секрецией антидиуретического гормона (СНАДГ), или отечным синдромом при хронической сердечной недостаточности.
Клиника экспериментальной терапии НИИ КО РОНЦ имени Н.Н. Блохина РАМН,
Ветеринарная клиника «Биоконтроль».
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии — ВИТАР»
Актуальность проблемы адекватного кровозамещения и проведения рациональной инфузионной терапии не вызывает сомнений особенно при выполнении высокоинвазивных хирургических манипуляций. Рациональная инфузионная терапия одно из главных составляющих успешного лечения большинства хирургических пациентов. Исключения составляют лишь «малые» не осложненные операции типа кастрации и грыжесечения. Роль инфузионной терапии, ее масштаб и сложность зависят от целого ряда обстоятельств: объема и сложности вмешательства, общего состояния пациента, уровня и обширности поражения органов, специфики заболевания (воспалительный процесс, злокачественная опухоль) [1,9].
Трудности с получением препаратов крови, аллергическая реакция, нехватка доноров, инфицирования и другие организационные моменты усиливают сложность этой проблемы [4].
В связи с этим у клиницистов проявляется значительный интерес к использованию коллоидных плазмозаменителей. Коллоидные растворы представляют собой водные растворы крупных молекул, вес которых превышает 10000 дальтон (Да). Эти молекулы плохо проникают через эндотелий капилляров, поэтому коллоидные растворы повышают онкотическое давление плазмы [2]. Весь объем введенного коллоидного раствора остается в плазме, что приводит к большему увеличению объема циркулирующей крови (ОЦК), чем при использовании кристаллоидов.
Эффект увеличения ОЦК временный, его выраженность и продолжительность зависят от типа коллоидного раствора [7].
Выбор кровезаменителя определяется особенностями патологии, состоянием водно- электролитного гомеостаза, знанием врача функциональных особенностей плазмозаменителя, а также его доступностью.
Существует такое понятие как «идеальный плазмозаменитель». Он должен отвечать определенным требованиям:
- Высокий волемический эффект (не менее 1.0).
- Достаточно длительный период полувыведения.
- Благоприятное влияние на гемореологию.
- Отсутствие депрессивного влияния на иммунную систему.
- Отсутствие анафилаксических реакций.
- Отсутствие влияния на синтез сывороточного альбумина печенью.
Также существенное значение имеет простота хранения и транспортировки, а также его фармако-экономические показатели.
Плазмозаменители подразделяются на два основных класса:
- Плазма донорской крови и препараты крови (растворы сывороточного альбумина).
- Растворы синтетических коллоидов.
Плазма донорской крови.
Волемический эффект донорской плазмы крови (менее 1,0) оставляет за собой роль исключительного гемостатика для случаев значимой патологии гемостаза. Поэтому основными показаниями к применению плазмы являются: гипопротеинемия, гипоальбуминемия и недостаток факторов свертываемости.
Альбумины.
Использования человеческого сывороточного альбумина (ЧСА), в настоящие время пересматривается относительно применения его в интенсивной терапии. Исходя из особенностей биологических эффектов (опасность «утечки» из кровеносного русла через поврежденный эндотелий сосуда и др.), клиницисты все чаще рассматривают ЧСА как не эффективный плазмозаменитель в медицине критических состояний [4, 5, 8].
На основании рандомизированных данных в гуманной медицине делается вывод о том, что не следует использовать растворы ЧСА в лечение пациентов с гиповолемией, ожогами и значительной гипопротеинемией, поскольку такая тактика не только не уменьшает летальность, но и напротив ее существенно увеличивает [4].
Более того, рассматриваются некоторые предостережения относительно его широкого применения, если концентрация в плазме не достигает критического уровня. Поэтому предлагают использовать ЧСА только в частных клинических случаях: как лекарственное средство – транспорт медикаментов, как специфический антиоксидант (для связывания избытка образовавшегося оксида азота), как средство подавление избытка продукции ренина при гепаторенальном синдроме. Согласно шокирующим данным Cohrane [5], смертность в группе пациентов отделения реанимации, получивших растворы альбумина, оказались достоверно выше, чем в контрольной.
В клинической практике применяют 4.5 % раствор ( изоонкотический ) и 20 % ( гиперонкотический) раствор человеческого альбумина.
Концентрированный 20 % раствор альбумина вызывает перемещение жидкости из интерстициального пространства в сосудистое русло.
Синтетические коллоиды.
Растворы синтетических коллоидов подразделяются на три класса:
- Плазмозаменители на основе желантина.
- Плазмозаменители на основе декстрана.
- Плазмозаменители на основе гидроксиэтилкрахмала.
Плазмозаменители на основе желатина, вырабатываются из желатина костного мозга крупного рогатого скота. В процессе приготовления его постепенно нагревают и окисляют перекесью водорода [6].
Типичным представителем на отечественном рынке являются препараты Гелофузин B. Braun, желатиноль. Желатиноль, имеет широкий диапозон молекулярно-массового распределения – от 5 до 100 кД. Минусами при работе с данными препаратами является:
- Низкий волемический эффект (около 0.5).
- Короткий период полувыведения (1-2 часа).
- Опасность «утечки» активного вещества в интерстициальное пространство.
- Нередкие анафилактоидные реакции.
- Рецидив исходных гемореологических расстройств (агрегация тромбоцитов, секвестрация эритроцитов).
- Избыток кальция в желатиноле, что исключает применение данного препарата с цитратными трансфузионными средами и некоторыми лекарственными препаратами.
Следует отметить, что препараты желатиноля в США считаются настолько опасными, что исключены к применению [5].
Плазмозаменители на основе декстрана.
Декстран представляет собой полисахарид, состоящий из линейных остатков глюкозы. На данный момент эта группа препаратов относятся к одним из самых популярных плазмозаменителей в нашей стране используемых как в медицине, так и в ветеринарии.
Достоинства плазмозаменителий на основе декстрана:
- Высокая водоудерживающая способность и высокий волемический эффект (превышает 1.0).
- Благоприятно влияет на гемореологию, характерная особенность для низкомолекулярных декстранов.
- Антитромботическое действие.
- Благоприятный фармакоэкономический показатель.
Кроме того, декстраны обладают специфическим защитным свойством в отношении ишемических и реперфузиознных повреждений, риск которых всегда увеличивается при обширных хирургических вмешательствах. В последние годы при производстве активного вещества декстранов улучшилась очистка этих препаратов от анафилактоидных компонентов, что существенно снижает количество аллергических реакций при использовании их в практике. Однако остаются и некоторые неблагоприятные эффекты этих плазмозаменителей:
- Торможение синтеза альбумина печенью.
- Декстран выделяется только почками, поэтому не могут применяться при острой почечной недостаточности. Некоторые специалисты полагают, что декстраны опасны способностью вызывать «ожоги» эпителия почечных канальцев и поэтому противопоказаны при ишемии и почечной недостаточности.
- Аллергическая реакция.
- При многократном применение, на протяжении значительного периода времени, развитие так называемого приобретенного тезариусмоса с блокадой клеток Купфера и появление системных реакций на транслокацию кишечной микрофлоры.
- На фоне дегидратации и олигоурии возможность развития ятрогенных патологий – осмотического нефроза – «декстрановая почка».
- Опасность существенных расстройств гемостаза при использовании значительных доз на фоне нестабильного гемостаза: декстрановая коагулопатия не имеет антидотов.
Все эти обстоятельства и прогресс науки привели к появлению нового класса препаратов плазмозаменителей на основе гидроксиэтилированного крахмала (ГЭК).
Гидроксиэтиловый крахмал – это исходное название полимерной молекулы, полученной из восковидного маиса или сорго и состоящей главным образом из амилопектина (98%). Амилопектин – это полисахарид со сложной разветвленной структурой, сильно напоминающий гликоген.
Отличительной способностью данных плазмозаменителей на основе ГЭК является:
- Молекулярная масса
- Молекулярное замещение
- DS – степень замещения: число гидроксильных групп на глюкозную единицу ГЭК – это основной показатель, отражающий время циркуляции активного компонента в сосудистом русле.
Растворы гидроксиэтилкрахмала отличаются большим диапазоном молекулярного веса. Чем выше концентрация, молекулярный вес и степень замещения, тем больше и продолжительней увеличивается ОЦК. С другой стороны, чем больше степень замещения, тем выраженнее побочные эффекты [2,3].
Характеристика наиболее распространенных гидроксиэтилкрахмалов приведена в таблице 1.
| ГЭК | Молекулярная масса( Тыс. Да) | Степень замещения | Концентрация |
| Hespan | 450 | 0.7 | 6% |
| Инфукол | 200 | 0.5 | 6%, 10% |
| Рефортан | 200 | 0.5 | 6%, 10% |
| HAES – стерил | 200 | 0.5 | 6%, 10% |
| Гемохес | 200 | 0.5 | 6%, 10% |
| Волювен | 130 | 0.4 | 6% |
| Венофундин | 130 | 0.4 | 6% |
- Высокий непосредственно волемический эффект
- Нет «утечки» активного вещества в интерстиции жизненно важных органов, например легкие.
- Длительное время циркуляции.
- ГЭК выделяется преимущественно через почки, но может частично метаболизироватся.
- В отличии от ЧСА, ГЭК блокирует синтез эндотелинов на фоне системной воспалительной реакции.
- Раствор ГЭК умеренно тормозит синтез альбуминов.
- Анафилактические реакции не описаны.
Кроме восстановления объема гидроксиэтеловый крахмал делает обратимыми изменения проницаемости капилляров, вызванные свободными радикалами кислорода при повреждении вследствие реперфузии [3]. Кроме того, он улучшает микроциркуляцию, хотя пока не известно является ли это следствием улучшением капиллярной перфузии [5].
В таблице 2 представлены дозы введения всех видов плазмозаменителей.
| Плазмозаменитель | Плазма | Альбумины | Желантины | Декстраны | ГЭК |
| Кошки | 10 мл/кг | 10 – 20 мл/кг | 5 – 20 мл/кг | 5 мл/кг | 5 – 10 мл/кг |
| Собаки | 250 мл на 10, 20 кг | 10 – 20 мл/кг | 5 – 20 мл/кг | 20 мл/кг | 10 – 40 мл/кг |
В дозах до 100 мл/кг ГЭК, не является токсичным для собак и не вызывает у них аллергию (Ballinger et al., 1996) [6].
Материалы и методы.
За период с 5.06.2005 по 10.05.2006 в Клинике экспериментальной терапии НИИ КО РОНЦ им. Н.Н. Блохина РАМН было прооперировано 156 животных в возрасте от 3 до 20 лет с кровопотерей от 15 до 70% ОЦК. Из них 62 животных (39.8%) по поводу рака молочной железы, 6 (3.8%) торакотомий, 35 (22.4%) лапаротомий (из них 10(6.5%) лобэктомий, 3 (1.9%) нефроэктомии, 14 (8.9%) спленэктомий, 8 (5.1%) операций по поводу рака предстательной железы), 16 (10.3%) ампутаций, 16 (10.3%) ламинэктомий, 21 (13.4%) операция по поводу опухолей голова и шеи. Величину кровопотери оценивали общепринятым гравиметрическим способом по кровяным салфеткам и отсосу. Во время операции осуществляли мониторинг частоты сердечных сокращений (ЧСС), артериального давления (систолического, диастолического и среднего) и сатурацию кислорода не инвазивным методом с помощью пульсоксиметра. Восполнение физиологических потребностей во время операций обеспечивали раствором Рингера – лактат и другими изотоническими солевыми растворами. Также всем животным проводилась терапия гидроксиэтилкрахмалами ( Рефортан 6%). При кровопотери более 15% ОЦК, дозы ГЭК составляли 8-12 мл/кг, при кровопотери более 30% ОЦК 12- 20мл/кг, при кровопотери более 50% 20-40 мл/кг.
Результаты.
При оценке данных мониторинга состояния гемодинамики (ЧСС, АД) насыщения гемоглобина кислородом оставалось в пределах нормы или было чуть ниже нормы даже при такой патологии как разрыв селезенки. У трех животных с острым кровотечением в послеоперационный период мы наблюдали нарушения со стороны гемостаза. 2 животных погибло через несколько часов после операции, с признаками развития синдрома дессеменированого внутрисосудистого свертывания.
Выводы.
Среди плазмозаменителей предпочтительны производные гидроксиэтилкрахмала и декстрана. Альбумины несут в себе больше побочных свойств и поэтому ведутся исследования по уточнению реальной клинической эффективности альбумина и его побочных свойств. Вполне вероятно, что скоро он будет полностью вытеснен более эффективными, безопасными и дешевыми препаратами ГЭК. Среди препаратов ГЭК предпочтительны низкомолекулярные, однако эти препараты еще не совсем доступны для свободного пользования.
Summary
Plasma substitutes in intensive care of small animals.
(Author: Kornushenkov E.A.; Clinic of experimental therapy GURONC named after N.N. Blohin RAMN)
Derivatives of hydroxyethylamylum and dextran are most preferable among plasma substitutes. Albumins bear more side effects therefore researches are performed to define the real clinical efficiency of albumin and its side effects.
It is most probably that soon albumin will be fully replaced by more effective, safe and cheap medications of hydroxyethylamylum.
Литература
1. Е.С. Горобец. // Современные тенденции в периоперационной инфузионной терапии. Анестезиология и реаниматология №3, 2002.
2. Гилберт Парк, Пол Роу.// Инфузионная терапия. Издательство Бином, Москва 2005.
3. Е.В. Елагин, В.А. Михельсон, А.Л. Галустьян, О.В. Михеев, Е.А. Казиахмедов, О.А. Гольдина, Ю.В. Горбачевский. // Влияние нового современного лекарственного средства инфукол ГЭК, на основе гидорксиэтилированного крахмала 200/0,5 второго покаления на систему гемостаза при ортопедических операциях у детей. – Вестник интенсивной терапии, Москва 2004.
4. А. П. Зилбер. // Кровопотеря и гемотрансфузия. Издательство Петрозаводского университета. Петрозаводск. 1999.
5. А.Л. Костюченко. // Волемически активные плазмозаменители в интенсивной терапии – материалы Ассоциации Анестезиологов и Реаниматологов Северо – Запада. Санкт – Петербург 2004.
6. Р. Кирк, Д. Бонагура. // Современный курс ветеринарной медицины Кирка. Аквариум, 2005.
7. Мокеев И.Н. // Инфузионно – трансфузионная терапия. Москва 2002.
8. Н.А. Степанова, А.У. Лекманов, В.А Красовский, Я.В. Олейников, Е.В. Михайлов, Ю.В. Горбачевский, О.А. Гольдина, Т.Е. Табакина. // Инфузионно — трансфузионная терапия острой кровопотери во время ранних операций у детей с тяжелой термической травмой. – Анестезиология и реаниматология № 2, 2004.
9. А. Шандер. // Бескровные методы лечения. Альтернативы переливанию крови. Материалы международных симпозиумов проблемы бескровной хирургии. Москва 2001.
Белки и белковые фракции. Общий белок в сыворотке
В норме концентрация общего белка в сыворотке у собак – 51-72 г/л, у кошек – 58-82 г/л.
У новорожденных концентрация белка ниже нормы (примерно около 40 г/л), но повышается после всасывания иммуноглобулинов, находящихся в молозиве. С возрастом концентрация белка продолжает нарастать.
Гипопротеинемия – пониженный уровень общего белка в крови.
Причины:
1. Гипергидратация (совместно со снижением гематокрита) – относительная
гипопротеинемия;
2. Повышенная потеря белка:
– кровопотери (совместно со снижением гематокрита);
– различные заболевания почек с нефротическим синдромом (за счет потери в основном альбуминов);
– ожоги;
– новообразования;
– сахарный диабет (за счет потери в основном альбуминов);
– асцит (за счет потери в основном альбуминов).
3. Недостаточное введение белка:
– длительное голодание;
– продолжительное соблюдение безбелковой диеты.
4. Нарушение образования белка в организме:
– недостаточная функция печени (гепатиты, циррозы, токсические повреждения);
– длительное лечение кортикостероидами;
– нарушение всасывания (при энтеритах, энтероколитах, панкреатитах).
5. Сочетание различных из перечисленных факторов.
Гиперпротеинемия – повышение концентрации общего белка в крови.
Причины:
1. Дегидратация (в результате потери части внутрисосудистой жидкости):
– тяжелые травмы;
– обширные ожоги;
– неукротимая рвота;
– тяжелая диарея.
2. Острые инфекции (в результате дегидратации и возрастания синтеза белков острой фазы).
3. Хронические инфекции (в результате активации иммунологического процесса и повышенного образования иммуноглобулинов).
4. Появление в крови парапротеинов (образуются при миеломной болезни, хронических гнойных процессах, хронических инфекционных болезнях и т. д.).
5. Физиологическая гиперпротеинемия (активная физическая нагрузка).
Причины ошибочно завышенной концентрации общего белка в плазме крови:
1. Увеличение концентрации небелковых веществ в плазме – липидов, мочевины,
глюкозы, экзогенных агентов (при определении рефрактометром).
2. Липидемия, гипербилирубинемия и значительная гемоглобинемия (при биохимическом
определении).
Альбумин в сыворотке
Концентрация альбумина в сыворотке крови в норме у собак – 24-45 г/л, у кошек – 24-42 г/л. Содержание альбумина в сыворотке крови составляет у собак 45-57%, у кошек – 38- 55% от общего белка.
Альбумины синтезируются печенью (примерно 15 г/сутки), время их полураспада в крови – около 17 суток.
Гипоальбуминемия – низкая концентрация альбуминов в плазме крови.
Гипоальбуминемия ниже 15 г/л ведет к появлению гипопротеинемических отеков и водянок.
а) Первичная идиопатическая – у новорожденных в результате незрелости печеночных клеток.
б) Вторичная – обусловленная различными патологическими состояниями:
1. Гипергидратация;
2. Потери альбумина организмом:
– кровотечение (вместе с уменьшением количества глобулинов);
– нефропатии с потерей белка (развитие нефротического синдрома);
– энтеропатии с потерей белка (вместе с уменьшением количества глобулинов);
– сахарный диабет;
– сильная экссудация при острых воспалениях;
– обширное поражение кожи (ожоги вместе с уменьшением количества глобулинов);
– потеря лимфы при лимфоррагиях, хилотораксе, хилезном асците.
3. Секвестрация альбумина в брюшной (асцит) и/или плевральной (гидроторакс) полостях или подкожной клетчатке:
– повышенное внутрисосудистое давление;
– нарушение циркуляции крови (правосторонняя сердечная недостаточность с повышением давления в печеночной вене);
– повышение давления в печеночной вене различного генеза (шунт, цирроз, новообразования и т. д.) с последующим развитием асцита;
– васкулопатии с повышенной проницаемостью сосудов.
4. Снижение синтеза альбумина из-за первичного поражения печени:
– циррозы печени;
– гепатиты;
– липидоз печени (кошки);
– токсические повреждения печени;
– первичные новообразования и метастазы опухолей, лейкозные поражения печени;
– врожденные портосистемные шунты;
– большая потеря массы печени.
5. Снижение синтеза альбумина без первичного поражения печени:
– гипоальбуминемия индуцированная цитокинами связанными с внепеченочной локализацией воспаления;
– гиперглобулинемия (в т.ч. гипергаммаглобулинемия);
6. Недостаточное поступление:
– длительная диета с низким содержанием белка или безбелковая;
– длительное голодание полное или неполное;
– недостаточность экзокринной функции поджелудочной железы (недостаточность пищеварения);
– недостаточность всасывания (мальабсорбция) при различных болезнях тонкого кишечника (энтеропатии).
7. Снижение функции надпочечников (гипоадренокортицизм собак);
8. Гемодилюция (при беременности);
9. Сочетание вышеперечисленных факторов.Гиперальбуминемия – увеличение содержания альбуминов в сыворотке крови.
Увеличение абсолютного содержания альбуминов, как привило, не наблюдается.
Причины относительной гиперальбуминемии:
1. Дегидратация различного генеза (относительная гиперальбуминемия, развивается одновременно с относительной гиперглобулинемией);
2. Ошибка определения.
Глобулин в сыворотке
Гипоглобулинемия – снижение в сыворотке крови общего содержания глобулинов.
Причины:
1. Гипергидратация (относительная, развивается одновременно с гипопротеинемией и гипоальбуминемией);
2. Выведение глобулинов из организма:
– кровопотеря (развивается одновременно с гипопротеинемией и гипоальбуминемией);
– массивная экссудация (развивается одновременно с гипопротеинемией и гипоальбуминемией);
– энтеропатии с потерей белка (развиваются одновременно с гипопротеинемией и гипоальбуминемией);
3. Нарушение синтеза глобулинов по различным причинам (см. гипопротеинемия);
4. Нарушение переноса иммуноглобулинов из молозива у новорожденных животных.
Ошибочная гипоглобулинемия может быть результатом завышенной концентрации альбуминов (так как количество глобулинов – расчетная величина).
Гиперглобулинемия – повышение в сыворотке крови общего содержания глобулинов.
Причины:
1. Дегидратация различного генеза (вместе с гиперальбуминемией);
2. Усиление синтеза глобулинов:
– воспалительные процессы после тканевых повреждений и/или в ответ на чужеродные антигены;
– неопластические В-лимфоциты и плазматические клетки (множественная миелома, плазмоцитома, лимфома, хронический лимфолейкоз).
Для правильной интерпретации гиперглобулинемии нужно учитывать данные определения общего альбумина и результаты электрофоретического исследования сывороточных белков по фракциям.
Изменение фракции α-глобулинов
К α-глобулинам относится основная масса белков острой фазы.
Увеличение их содержания отражает интенсивность стрессорной реакции и воспалительных процессов.
Причины увеличения фракции α-глобулинов:
1. Острые и подострые воспаления, особенно с выраженным экссудативным и гнойным характером;
– пневмонии;
– пиометра;
– эмпиема плевры и др.
2. Обострение хронических воспалительных процессов;
3. Все процессы тканевого распада или клеточной пролиферации;
4. Поражение печени;
5. Заболевания, связанные с вовлечением в патологический процесс соединительной ткани:
– коллагенозы;
– аутоиммунные болезни.
6. Злокачественные опухоли;
7. Стадия восстановления после термических ожогов;
8. Нефротический синдром;
9. Гемолиз крови в пробирке;
10. Введение фенобарбитала собакам;
11. Повышение концентрации эндогенных глюкокортикоидов (синдром Кушинга) или введение экзогенных глюкокортикоидов.
Причины уменьшения фракции α-глобулинов:
1. Уменьшение синтеза вследствие нехватки ферментов;
2. Сахарный диабет;
3. Панкреатит (иногда);
4. Токсические гепатиты.
Изменение фракции β-глобулинов
Бета-фракция содержит трансферрин, гемопексин, компоненты комплемента, иммуноглобулины (IgM) и липопротеиды.
Причины увеличения фракции β-глобулинов:
1. Первичные и вторичные гиперлипопротеидемии;
2. Нефротический синдром;
3. Заболевания печени;
4. Гипотиреоз;
5. Кровоточащие язвы желудка;
6. Дефицит железа, хронические гемолитические анемии.
Причины уменьшения фракции β-глобулинов:
1. Анемии, связанные с воспалительными заболеваниями (отрицательный острофазный белок).
Изменение фракции γ-глобулинов
Гамма-фракция содержит иммуноглобулины G, D, частично (вместе с бета-фракцией) иммуноглобулины А и Е.
Причины увеличения фракции γ-глобулинов (гипергаммаглобулинемии):
1. Поликлональная гипергаммаглобулинемия или поликлональная гаммапатия (часто совместно с повышением концентрации α2-глобулина, преимущественно при хронических воспалительных или неопластических процессах):
– пиодермия;
– дирофиляриоз;
– эрлихиоз;
– инфекционный перитонит (кошки);
– деструкции (некрозы) тканей, в том числе в крупных неоплазиях;
– ожоги;
– вирусные и/или бактериальные болезни;
– хронические активные гепатиты (к примеру, при хроническом лептоспирозе);
– циррозы печени (если содержание γ-глобулинов превышает содержание α-глобулинов, это плохой прогностический признак);– системная красная волчанка;
– ревматоидный артрит;
– эндотелиомы;
– остеосаркомы;
– кандидамикоз.
2. Моноклональная гипергаммаглобулинемия (моноклональная гаммапатия – появляются патологические протеины – парапротеины):
– клональная пролиферация неопластических клеток типа В-лимфоцитов или плазматических клеток;
– множественная миелома;
– плазмоцитома;
– лимфома;
– хронический лимфолейкоз;
– амилоидоз (редко);
– обширная пролиферация плазматических клеток, не связанная с опухолевым ростом:
– эрлихиоз;
– лейшманиоз;
– плазмоцитарный гастроэнтероколит (собаки);
– лимфоплазмоцитарный стоматит (кошки).
– идиопатическая парапротеинемия.
Причины уменьшения фракции γ-глобулинов (гипогаммаглобулинемия):
1. Первичная гипогаммаглобулинемия:
– физиологическая (у новорожденных животных, примерно до 1 месяца);
– врожденная (наследственный дефект синтеза иммуноглобулинов: комбинированный иммунодефицит бассетов, акродерматит бультерьеров; врожденная селективная недостаточность IgA и IgM у биглей, шарпеев и немецких овчарок);
– идиопатическая.
2. Вторичная гипогаммаглобулинемия (различные болезни и состояния, приводящие к истощению иммунной системы):
– инфекция вирусом лейкоза кошек маленьких котят;
– инфекция вирусом иммунодефицита кошек;
– различные бактериальные болезни, паразитарные (демодекоз) и вирусные болезни (чума плотоядных, парвовирусный энтерит собак, панлейкопения кошек);
– неопластические заболевания, особенно заболевания кроветворной системы;
– хронические болезни почек с уремией;
– сахарный диабет;
– недостаточное или неправильное питание;
– беременность и лактация;
– аутоиммунные болезни.
Интерпретация данных, полученных при одновременном определении концентрации альбумина и общего глобулина.
а) Нормальная концентрация альбумина.
1. Низкая концентрация глобулинов:
– отсутствие пассивного переноса иммуноглобулинов у новорожденных;
– приобретенные или наследственные дефекты синтеза иммуноглобулинов.
2. Нормальная концентрация глобулинов – нормальное состояние.
3. Высокая концентрация глобулинов:
– повышение синтеза глобулинов;
– гипоальбуминемия, маскируемая дегидратацией.
б) Высокая концентрация альбумина.
1. Низкая концентрация глобулинов – ошибка определения, приводящая к ложному завышению концентрации альбумина.
2. Нормальная концентрация глобулинов – маскируемая дегидратацией гипоглобулинемия.
3. Высокая концентрация глобулинов – дегидратация.
в) Низкая концентрация альбумина.
1. Низкая концентрация глобулинов:
– значительная происходящая или недавно случившаяся кровопотеря;
– массивная экссудация;
– энтеропатия с потерей белка.
2. Нормальная концентрация глобулинов:
– нефропатия с потерей белка;
– конечная стадия болезней печени (цирроз);
– нарушения питания;
– гипоадренокортицизм у собак;
– васкулопатии различного генеза (эндотоксемии, септицемия, иммуноопосредованный васкулит, инфекционный гепатит);
– повышенное гидростатическое давление (портальная гипертензия, застойная правосторонняя сердечная недостаточность);
– перитонеальный диализ.
3. Высокая концентрация глобулинов:
– острое, подострое воспаление или хроническое воспаление в стадию обострения;
– множественная миелома, лимфома, плазмоцитома, лимфопролиферативные заболевания.
Биохимический анализ крови. 
Биохимический анализ крови – это метод лабораторной диагностики, позволяющий оценить работу многих внутренних органов. Стандартный биохимический анализ крови включает определение ряда показателей, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов сыворотки крови.
На исследование берут кровь строго натощак в пробирку с активатором свертывания, исследуют сыворотку крови.
- Общие биохимические показатели.
Общий белок.
Общий белок – это общая концентрация всех белков крови. Существуют различные классификации белков плазмы. Наиболее часто их разделяют на альбумин, глобулины (все другие белки плазмы) и фибриноген. Концентрация общего белка и альбумина определяется с помощью биохимического анализа, а концентрация глобулинов путем вычитания концентрации альбумина из общего белка.
— заболевания, сопровождающиеся активацией иммунной системы (аутоиммунные и аллергические заболевания, хронические инфекции и т.д.),
Ложное завышение белка может происходить при липемии (хилез), гипербилирубинемии, значительной гемоглобинемии (гемолиз).
— недостаток белка в пище,
— длительные хронические болезни, характеризующиеся истощением иммунной системы (инфекции, новообразования),
— лечение цитостатиками, иммунодепресантами, глюкокортикостероидами и др.
При кровотечении концентрация альбумина и глобулинов падает параллельно, однако при некоторых расстройствах, сопровождающихся потерей белка, снижается преимущественно содержание альбумина, так как размер его молекул меньше по сравнению с другими белками плазмы.
Альбумин
Гомогенный белок плазмы, содержащий небольшое количество углеводов. Важной биологической функцией альбумина в плазме является поддержание внутрисосудистого коллоидно-осмотического давления, благодаря чему предотвращается выход плазмы из капилляров. Поэтому существенное снижение уровня альбумина приводит к появлению отеков и выпотов в плевральную или брюшную полости. Альбумин служит молекулой – переносчиком, транспортируя билирубин, жирные кислоты, лекарственные средства, свободные катионы (кальций, медь, цинк), некоторые гормоны, различные токсические агенты. Так же собирает свободные радикалы, связывает медиаторы воспалительных процессов, представляющих опасность для тканей.
Расстройства, которые сопровождались бы усилением синтеза альбумина, не известны.
— нефропатии и энтеропатии,
— сильная экссудация (например, ожоги);
— хроническая недостаточность печени,
— недостаток белка в пище,
— недостаточность экзокринной функции поджелудочной железы
Билирубин.
Билирубин продуцируется в макрофагах путем ферментативного катаболизма фракции гема из различных гемпротеидов. Большая часть циркулирующего билирубина (около 80%) образуется из «старых» эритроцитов. Погибшие «старые» эритроциты разрушаются ретикулоэндотелиальными клетками. При окислении гема образуется биливердин, который метаболизируется до билирубина. Оставшаяся часть циркулирующего билирубина (около 20%) образуется из других источников (разрушение зрелых эритроцитов в костном мозге, содержащих гем, миоглобин мышц, ферменты). Образованный таким образом билирубин циркулирует в кровотоке, транспортируясь в печень в форме растворимого билирубин-альбуминового комплекса. Связанный с альбумином билирубин может быть легко извлечен из крови печенью. В печени билирубин связывается с глюкуроновой кислотой под влиянием глюкуронилтрансфераз. Связанный билирубин включает билирубин-моноглюкуронид, который преобладает в печени, и билирубин-диглюкуронид, который преобладает в желчи. Связанный билирубин транспортируется в желчные капилляры, откуда он поступает в желчевыводящие пути, а затем в кишечник. В кишечнике связанный билирубин подвергается ряду превращений с формированием уробилиногена и стеркобилиногена. Стеркобилиноген и небольшое количество уробилиногена выводятся с фекалиями. Основное количество уробилиногена вторично всасывается в кишечнике, достигая печени через портальное кровообращение и реэкскретируясь желчным пузырем.
Уровни сывороточного билирубина растут тогда, когда его продукция превышает его метаболизм и выведение из организма. Клинически гипербилирубинемия выражается желтухой (желтая пигментация кожи и склер).
Это связанный билирубин, растворимый и с высокой реакционной способностью. Повышение уровня прямого билирубина в сыворотке крови связано с пониженной экскрецией конъюгированного пигмента из печени и желчевыводящих путей и проявляется в виде холестатической или гепатоцеллюлярной желтухи. Патологический рост уровня прямого билирубина ведет к появлению этого пигмента в моче. Поскольку непрямой билирубин не выводится мочой, наличие билирубина в моче подчеркивает увеличение в сыворотке крови уровня связанного билирубина.
Сывороточная концентрация неконъюгированного билирубина обусловлена скоростью, с которой вновь синтезированный билирубин проникает в плазму крови и скоростью элиминации билирубина печенью (печеночный клиренс билирубина).
Непрямой билирубин вычисляется расчетным способом:
непрямой билирубин = общий билирубин — прямой билирубин.
— ускоренное разрушение эритроцитов (гемолитическая желтуха),
— гепатоцеллюлярное заболевание (печеночное и внепеченочное происхождение).
Хилез может обусловить ложно завышенную величину содержания билирубина, что следует учитывать, если высокий уровень билирубина определяется у пациента в отсутствии желтухи. «Хилезная» сыворотка крови приобретает белый цвет, что связано с повышенной концентрацией хиломикронов и\или липопротеинов очень низкой плотности. Чаще всего хилез является результатом недавнего приема пищи, однако у собак ее могут вызывать такие заболевания как сахарный диабет, панкреатит, гипотиреоз.
Клинического значение не имеет.
Собака – 2.0-13.5 мкмоль/л
Кошка – 2.0-10.0 мкмоль/л
Собака – 0-5.5 мкмоль/л
Кошка – 0-5.5 мкмоль/л
Аланинаминотрансфераза (АЛТ)
АЛТ – эндогенный фермент из группы трансфераз, широко используемый в медицинской и ветеринарной практике для лабораторной диагностики повреждений печени. Синтезируется внутриклеточно, и в норме лишь небольшая часть этого фермента попадает в кровь. Если энергетический метаболизм клеток печени нарушается инфекционными факторами (например, вирусный гепатит) или токсическими, то это приводит к увеличению проницаемости клеточных мембран с прохождением в сыворотку компонентов цитоплазмы (цитолиз). АЛТ является показателем цитолиза, самым изученным и самым показательным даже для обнаружения минимальных поражений печени. АЛТ является более специфичным для нарушений печени, чем АСТ. Абсолютные значения AЛT все же не коррелируют напрямую с тяжестью повреждений печени и с прогнозированием развития патологического процесса, и поэтому наиболее целесообразным являются серийные определения АЛТ в динамике.
— применение гепатотоксичных препаратов
— иногда при беременности
Собака 10-58 ед/л
Аспартатаминотрансфераза (АСТ)
Аспартатаминотрансфераза (АСТ) — эндогенный фермент из группы трансфераз. В отличие от АЛТ, который встречается, главным образом, в печени, АСТ присутствует во многих тканях: миокарде, печени, скелетных мышцах, почках, поджелудочной железе, ткани мозга, селезенке, являясь менее характерным показателем функции печени. На уровне клеток печени изоферменты АСТ находятся как в цитозоле, так и в митохондриях.
— Токсический и вирусный гепатит
— Некроз ткани печени
— Острый инфаркт миокарда
— Введение опиоидов пациентам с заболеваниями желчных путей
Увеличение и быстрое снижение предполагает обструкцию желчных внепеченочных путей.
Собака – 8-42 ед/л
Повышение АЛТ, превышающее повышение АСТ, характерно для повреждения печени; если же показатель АСТ повышается больше, чем повышается АЛТ, то это, как правило, свидетельствует о проблемах клеток миокарда (сердечной мышцы).
γ — глутамилтрансфераза (ГГТ)
ГГТ – это фермент, локализованный на мембране клеток различных тканей, катализирующий реакцию трансаминирования или переаминирования аминокислот в процессе их катаболизма и биосинтеза. Фермент переносит γ- глутамил с аминокислот, пептидов и других веществ на акцепторные молекулы. Эта реакция обратима. Таким образом, ГГТ участвует в транспорте аминокислот через клеточную мембрану. Поэтому наибольшее содержание фермента отмечается в мембране клеток с высокой секреторной и абсорбционной способностью: печеночные канальцы, эпителий желчных путей, канальцы нефрона, эпителий ворсинок тонкой кишки, панкреатические экзокринные клетки.
Так как ГГТ ассоциирована с эпителиальными клетками системы желчных протоков, она имеет диагностическое значение при нарушении функции печени.
— у собак при повышении концентрации глюкортикостероидов
— гепатиты вне- или внутрипеченочного происхождения, неоплазии печени,
— острый панкреатит, рак поджелудочной железы
— обострение хронического гломерулонефрита и пиелонефрита,
Клинического значения не имеет.
В отличие от АЛТ, которая содержится в цитозоле гепатоцитов и поэтому является чувствительным маркером нарушения целостности клеток, ГГТ обнаруживается исключительно в митохондриях и высвобождается только при значительном повреждении ткани. В отличие от человека, противосудорожные препараты, применяемые у собак, не взывают повышение активности ГГТ или оно минимально. У кошек при липидозе печени активность ЩФ повышается в большей степени, чем ГГТ. Молозиво и грудное молоко в ранние сроки кормления содержат высокую активность ГГТ, поэтому у новорожденных уровень ГГТ повышен.
Щелочная фосфатаза.
Этот фермент обнаруживается главным образом в печени (желчные канальцы и эпителий желчных протоков), канальцах почек, тонком кишечнике, костях и плаценте. Это связанный с мембраной клеток фермент, катализирующий щелочной гидролиз самых разнообразных веществ, в ходе которого происходит отщепление остатка фосфорной кислоты от ее органических соединений.
Общая активность ЩФ в циркулирующей крови здоровых животных складывается из активности печеночных и костных изоферментов. Доля активности костных изоферментов наиболее велика у растущих животных, в то время как у взрослых их активность может увеличиваться при опухолях костей.
— нарушение тока желчи (холестатическое гепатобилиарное заболевание),
— нодулярная гиперплазия печени (развивается при старении),
— повышение активности остеобластов (в молодом возрасте),
— заболевания костной системы (опухоли костей, остеомаляция др.)
— беременность (повышение ЩФ во время беременности происходит за счет плацентарного изофермента).
— У кошек может быть связано с печеночным липидозом.
Собака 10-70 ед/л
Альфа – амилаза
Амилаза — гидролитический фермент, участвующий в расщеплении углеводов. Амилаза образуется в слюнных железах и поджелудочной железе, затем поступает в полость рта или просвет двенадцатиперстной кишки соответственно. Значительно более низкой амилазной активностью обладают также такие органы как яичники, фаллопиевы трубы, тонкий и толстый кишечник, печень. В сыворотке крови выделяют панкреатический и слюнной изоферменты амилазы. Выводится фермент почками. Следовательно, увеличение сывороточной активности амилазы приводит к повышению активности амилазы в моче. Амилаза может образовывать крупные по размеру комплексы с иммуноглобулинами и другими белками плазмы, что не позволяет ей проходить через почечные клубочки, в результате чего содержание её в сыворотке возрастает, а в моче активность амилазы наблюдается нормальная.
— Панкреатит (острый, хронический, реактивный).
— Новообразования поджелудочной железы.
— Закупорка протока поджелудочной железы (опухолью, камнем, спайками).
— Сахарный диабет (кетоацидоз).
— Заболевания желчных путей (холелитиаз, холецистит).
— Травматические поражения брюшной полости.
— Острый и хронический гепатит.
Собака – 300-1500 ед./л
Кошка – 500-1200 ед./л
Панкреатическая амилаза.
Амилаза – фермент катализирующий расщепление (гидролиз) сложных углеводов (крахмала, гликогена и некоторых других) до дисахаридов и олигосахаридов (мальтоза, глюкоза). У животных значительная часть амилазной активности обусловлена слизистой тонкого кишечника и другими внепанкреатическими источниками. С участием амилазы в тонком кишечнике завершается процесс переваривания углеводов. Разнообразные нарушения процессов в ацинозных клетках экзокринной части поджелудочной железы, повышение проницаемости протока поджелудочной железы и преждевременная активация ферментов приводят к «утечке» ферментов внутри органа.
— тяжелые воспалительные заболевания кишечника (прободение тонкого кишечника, завороты),
— продолжительное лечение глюкокортикостероидами.
— некроз или опухоль поджелудочной железы.
Собака 243,6-866,2 ед/л
Кошка 150,0-503,5 ед/л
Глюкоза.
Глюкоза – основной источник энергии в организме. В составе углеводов глюкоза поступает в организм с пищей и всасывается в кровь из тощей кишки. Так же она может синтезироваться организмом в основном в печени и почках из неуглеводных компонентов. Потребность в глюкозе имеют все органы, но особенно много глюкозы используется тканями мозга и эритроцитами. Печень регулирует уровень глюкозы в крови посредством гликогенеза, гликолиза и глюконеогенеза. В печени и мышцах глюкоза запасается в виде гликогена, который используется для поддержания физиологической концентрации глюкозы в крови, прежде всего в промежутках между приемами пищи. Глюкоза является единственным источником энергии для работы скелетной мышцы в анаэробных условиях. Основными гормонами, влияющими на гомеостаз глюкозы, являются инсулин и дерегулирующие гормоны – глюкагон, катехоламины и кортизол.
— недостаточность инсулина или резистентность тканей к инсулину,
— физическая нагрузка и стресс (особенно у кошек),
— опухоли гипофиза (встречается у кошек),
— прием некоторых лекарственных средств (глюкокортикостероиды, тиазидные диуретики, внутривенное введение жидкостей, содержащих глюкозу, прогестины и др.),
Кратковременная гипергликемия возможна при травмах головы и поражениях ЦНС.
— опухоль поджелудочной железы (инсулинома),
— гипофункция эндокринных органов (гипокортицизм);
— продолжительное голодание и анорексия;
— врожденные портосистемные шунты;
— идиопатическая ювенильная гипогликемия у собак мелких и охотничьих пород,
При продолжительном контакте сыворотки крови с эритроцитами возможно падение глюкозы, так как эритроциты активно ее потребляют, поэтому кровь желательно как можно быстрее отцентрифугировать. Содержание глюкозы в неотцентрифугированной крови снижается приблизительно на 10 % в час.
Собака 4,3-7,3 ммоль/л
Кошка 3,3-6,3 ммоль/л
Креатинин
Креатин синтезируется в печени, и после высвобождения поступает в мышечную ткань на 98%, где происходит его фосфорилирование. Образованный фосфокреатин играет важную роль в запасании мышечной энергии. Когда данная мышечная энергия необходима для осуществления метаболических процессов, фосфокреатин расщепляется до креатинина. Креатинин является стойким азотистым составляющим крови, не зависящим от большинства пищевых продуктов, нагрузок или других биологических констант, и связан с метаболизмом мышц.
Нарушения функции почек снижает экскрецию креатинина, обуславливая повышение уровня сывороточного креатинина. Таким образом, концентрации креатинина приблизительно характеризуют уровень клубочковой фильтрации. Главная ценность определения сывороточного креатинина — это диагностика почечной недостаточности.
Сывороточный креатинин является более специфичным и более чувствительным показателем функции почек, в отличие от мочевины.
— острая или хроническая почечная недостаточность.
Обусловлено преренальными причинами вызывающими снижение скорости клубочковой фильтрации (обезвоживание, сердечно-сосудистые заболевания, септический и травматический шок, гиповолемия и др.), ренальными связанными с тяжелыми заболеваниями паренхимы почек (пиелонефрит, лептоспироз, отравления, неоплазии, врожденные расстройства, травмы, ишемия) и постренальными — обструктивными расстройствами, препятствующими выделению креатинина с мочой (обструкция мочеиспускательного канала, мочеточника или разрыв мочевыводящих путей).
— возрастное снижение мышечной массы.
Собака 26-130 мкмоль/л
Кошка 70-165 мкмоль/л
Мочевина
Мочевина образуется в результате катаболизма аминокислот из аммиака. Аммиак, образующийся из аминокислот токсичен и превращается с помощью ферментов печени в нетоксичную мочевину. Основная часть мочевины поступающая после этого в кровеносную систему легко фильтруется и экскретируется почками. Мочевина может так же пассивно диффундировать в интерстициальную ткань почек и возвращаться в кровоток. Пассивная диффузия мочевины зависит от скорости фильтрации мочи – чем она выше (например, после внутривенного введения диуретиков), тем ниже уровень мочевины в крови.
— почечная недостаточность (может быть обусловлена преренальными, ренальными и постренальными расстройствами).
— низкое поступление белка в организм,
Собака 3.5-9.2 ммоль/л
Кошка 5.4-12.1 ммоль/л
Мочевая кислота
Мочевая кислота – конечный продукт катаболизма пуринов.
Мочевая кислота всасывается в кишечнике, циркулирует в крови в виде ионизированного урата и выделяется с мочой. У большинства млекопитающих элиминация осуществляется печенью. Гепатоциты с помощью уреазы окисляют мочевую кислоту с образованием водорастворимого аллантоина, который экскретируется почками. Снижение метаболизма мочевой кислоты в сочетании с ослаблением метаболизма аммиака при портосистемном шунтировании ведет к образованию кристаллов урата с возникновением уратных камней (уролитиаз).
При портосистемном шунтировании (ПСШ) мочевая кислота, образованная в результате метаболизма пурина, практические не проходит через печень, так как ПСШ представляют собой прямую сосудистую связь воротной вены с системной циркуляцией в обход печени.
Предрасположенность собак с ПСШ к уратному уролитиазу связана с сопутствующей гиперурикемией, гипераммониемией, гиперурикурией и гипераммониурией. Так как мочевая кислота при ПСШ не попадает в печень, она не полностью конвертируется в аллантоин, что приводит к патологическому повышению сывороточной концентрации мочевой кислоты. При этом мочевая кислота свободно фильтруется клубочками, реабсорбируется в проксимальных канальцах и секретируется в канальцевый просвет проксимальных нефронов. Таким образом, концентрация мочевой кислоты в моче частично определяется ее концентрацией в сыворотке.
Далматинские доги предрасположены к образованию уратных кристаллов вследствие особенного метаболического нарушения печени, приводящего к неполному окислению мочевой кислоты.
— анемия, вызванная дефицитом витамина В12
— некоторые острые инфекции (пневмония, туберкулез)
Ветер Д.С. – руководитель терапевтического отделения ИВЦ МВА, ветеринарный врач, специалист визуальной диагностики.
Бобровский М.А. – ветеринарный врач-терапевт ИВЦ МВА соискатель кафедры ветеринарной хирургии.
Масимов Эдуард Нусратович - ветеринарный врач ИВЦ МВА , дерматолог, эндокринолог, терапевт, кандидат биологических наук.
Энтеропатии с потерей белка (PLE) - это синдром, характеризующийся хронической потерей белка в просвет желудочно-кишечного тракта животных. PLE достаточно редко встречается у человека, однако это довольно распространенное осложнение, встречающееся у собак и намного реже у кошек. Наиболее подверженными к данному синдрому породами собак являются: йоркширские терьеры, ротвейлеры, немецкие овчарки, норвежские лундехаунды, золотистые ретриверы, басенджи, боксеры, ирландские сеттеры, пудели, мальтезы и шарпеи.

Авторы статьи не выявили достоверной корреляции PLE с определенным полом и возрастом животных. Однако в одном исследовании сообщалось, что в 61% случаев PLE у йоркширских терьеров, это были самки; средний возраст животных составлял 7.7 ± 3.0 лет.
Как правило, данный синдром может развиться на фоне первичных воспалительных заболеваний кишечника (лифоцитарно-плазмоцитарного, эозинофильного энтерита и д.р.), лимфангиэктазии, лимфомы кишечника, грибкового поражения (гистоплазмоза), острого бактериального или вирусного энтеритов, аутоиммунных заболеваний кишечника и некоторых других патологических процессах. При этом клиническая картина может выглядеть несколько вариабельно, в зависимости от этиологии заболевания. Среди общих клинических признаков, отражающих наличие PLE, можно выделить следующее:
- Хроническую, реже острую, диарею.
- Разной степени выраженности кахексию.
- Хроническую рвоту. (Рвота - достаточно частый симптом. Однако она может отсутствовать у некоторого процента пациентов или присутствовать на сравнительно поздних этапах заболевания).
- Ухудшение или полное отсутствие аппетита.
- Периферические отеки конечностей.
- Наличие асцита, в более редких случаях гидроторакса.
Последние два симптома, обусловлены снижением онкотического давления крови, вследствие гипоальбуминемии (15-25 г/л). Животные с хронической диареей и рвотой, при несвоевременном обращении владельцев, могут поступать с симптомами анемии (от умеренной до ярко выраженной), дегидратации, гиповолемии/гиповолемического шока. Одышка и признаки дыхательной недостаточности могут наблюдаться у пациентов со скоплением значительного количества жидкости в грудной полости. Пальпация может выявить от умеренной до выраженной болезненность брюшной стенки, признаки флуктуации, объемные образования. В ходе проведения аускультации, возможно выявление признаков гидроторакса в виде приглушения звуков сокращения сердца. Следует отметить, что не у всех собак с PLE, присутствует выраженные клинические признаки; единственными симптомами могут быть снижение веса и гипоальбуминемия.
Во всех случаях гипоальбуминемии, с характерными для PLE клиническими признаками, проводимая диагностика должна быть достаточно агрессивной т.к. этиология синдрома разнообразна, а детальная проработка и исключение каждого заболевания по отдельности, а также оценка результативности эмпирически-назначенной терапии может занять достаточно много времени. Первой диагностической задачей, является установление причины потери белка. Исследование кожи необходимо для исключения поражений, способных привести к потере белка. Как правило, поражения кожи способные вызвать гипоальбуминемию, достаточно очевидны при первичном осмотре (например ожоги большой площади). Быстрый осмотр позволяет выяснить, действительно ли кожа является причиной гипоальбуминемии.
Следующим этапом диагностики является исключение нарушения синтеза альбумина печенью и потеря белка с мочой, вследствие нефропатий. Необходимо получить образцы мочи для проведения общего клинического анализа и оценки соотношения белок-креатинин, с целью установления факта протеинурии. В случае наличия серьезной нефропатии, у собак может наблюдаться разной степени выраженности азотемия. Исследование функции печени, должно включать определение уровня желчных кислот.
Концентрация аминотрансфераз зачастую возрастает при разрушении гепатоцитов, однако интерпретация значений активности АЛТ, АСТ, ГГТ и ЩФ, должны проводиться с осторожностью, так как у некоторых собак с тяжелыми, хроническими заболеваниями печени, не отмечается высокого уровня гепатоцеллюлярных ферментов. Уровень глобулинов может сохранятся на нормальном уровне или быть незначительно повышен например в случае гистоплазмоза. Абсолютная гипопротеинэмия встречается реже, в основном на поздних стадиях заболевания.
Гиперхолестеринемия в сочетании с гипоальбуминемией, более характерна для PLE (вторично к хронической мальабсорбции) или печеночной недостаточности. В тоже время гиперхолестеринемия в в сочетании с гипоальбуминемией, наводит на мысли о потери белка вследствие нефропатии. Снижение уровня сывороточного кальция (общего и ионизированного) имеет многофакторную этиологию, ассоциированную со снижением альбумина как основного транспортного белка, снижением усвоения витамина D и нарушением усвоения магния. В клиническом анализе крови может наблюдаться лимфопения, особенно в случаях лимфангиэктазии; достаточно часто можно встретить признаки регенераторной, анемии, вследствие снижения усвоения железа и цианокобаламина.
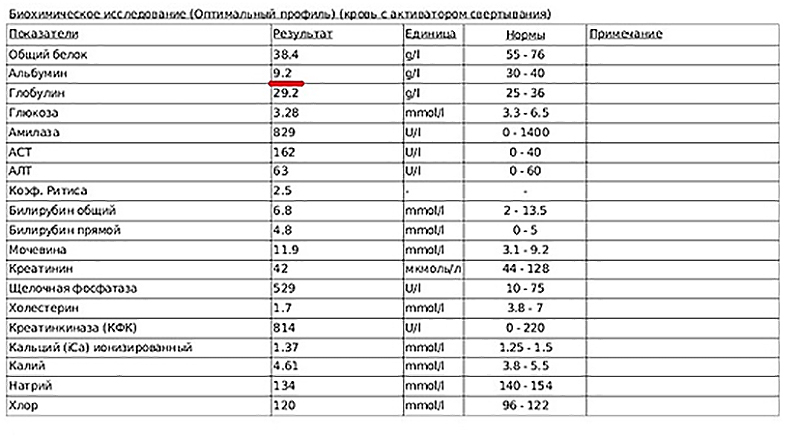
Рис 1. Биохимический анализ крови
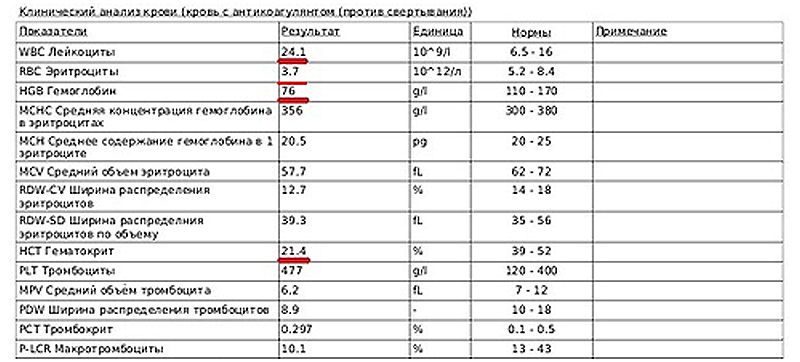
Рис 2. Клинический анализ крови
После исключения нарушений функций печени или заболеваний почек, при концентрации альбумина 15-25≤ г/л, PLE является разумным первичным диагнозом. Измерение ингибитора α1-антитрипсина (α1-протеазы) в образцах кала, может использоваться для дальнейшего подтверждения PLE. α1-антитрипсин имеет молекулярный вес, сходный с альбумином. Этот белок находиться в сосудистом и интерстициальном пространстве, в лимфе. В отличие от альбумина и других белков плазмы, α1-антитрипсин способен противостоять разложению кишечными и бактериальными протеазами. При PLE, могут наблюдаться потери α1-антитрипсина в просвет кишечника и выведение его с калом, что может быть определено методом иммуноферментного анализа. Данный тест достаточно трудоемок в плане соблюдения точной методологии забора, хранения и транспортировки образцов. Определение α1-антитрипсина в кале, является полезным исследованием как для непосредственной диагностики PLE, так и для уточнения диагноза в случае сочетанного течения PLE с печеночной недостаточностью или нефропатией. Однако интерпретация результатов данного исследования может вызвать определенные сложности. В целом этот тест редко используется в клинической практике. На территории РФ, данное исследование не проводится.
“Золотым стандартом” PLE, является определение количества меченого изотопом хром-51 альбумина в кале, после его внутривенного введения. Практическое применений данного теста, также ограничено.
Последующая диагностика должна быть направлена на выявление этиологии текущей энтеропатии. Проведение рентгенологических исследований, в том числе рентгеноконтрастных исследований ЖКТ, как правило являются мало информативными. Ультразвуковая диагностика является полезным исследованием для обнаружения специфических изменения кишечной стенки. Например утолщение стенки кишечника и наличие гиперэхогенных полос в подслизистом слое может свидетельствовать о наличии лимфангиэктазии. Еще более выражено эти признаки наблюдаются в случае приема жирной пищи накануне исследования, что приводит к большему расширению лимфатических сосудов стенки кишечника. Ультразвуковая диагностика может выявить очаговые изменения, не доступные для эндоскопической визуализации.
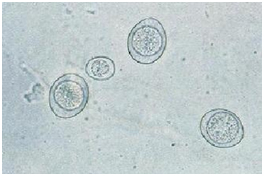
Исследование кала может выявить наличие яиц паразитов или простейших. Судановое окрашивание кала используется для определения стеатореи, что указывает на плохое усвоение жиров. Цитологическое исследование мазков фекалий может выявить гифы грибов.
Окончательный диагноз устанавливается после забора биоптатов для проведения гистологического исследования. Биопсия может быть выполнена посредством ЭГДС, лапаротомии или эндоскопически-ассистированной лапаротомии. Выбор того или иного метода забора биопсии зависит от многих факторов,таких как наличие эндоскопических навыков, наличие данных о вероятной локализации патологического очага, наличия необходимого эндоскопического оборудования и д.р.. Из преимуществ проведения лапаротомии, можно выделить возможность полнослойного забора биоптата а также возможность забора материала из нескольких сегментов кишечника, недоступных в случае применения гибкой эндоскопии. Однако понятие “полнослойный материал” не является синонимом “диагностически значимый”. Большое внимание должно быть уделено наложению серозно-мышечных швов, которые в случае PLE, могут представлять угрозу из-за длительной регенерации, и угрозы несостоятельности шва.
Во многих случаях очаги поражения невозможно увидеть со стороны серозной оболочки а т.к. некоторые причины PLE могут быть локально расположены в разных отделах кишечника, важно иметь возможность визуализировать их со стороны слизистой оболочки. В случае же забора материала во время проведения гибкой эндоскопии, возможно выявить характерные изменения слизистой оболочки кишечника и провести точечный забор материала. Забор материала нужно осуществлять из нескольких отделов кишечника, стараясь взять не менее 5-6 образцов из двенадцатиперстной и подвздошной кишки (по данным Willard, M., статистически, данный отдел кишечника наиболее часто вовлекается в патологический процесс приводящий к развитию PLE). Несмотря на то, что окончательный диагноз будет поставлен на основании патоморфологии, в некоторых случаях можно поставить предварительный диагноз (как в случае лимфангиэктазии) опираясь на характерные изменения слизистой оболочки, обнаруживаемые при эндоскопическом исследовании (многочисленные, диффузные, расширенные лимфатические сосуды, могут быть визуализированы как большие белые везикулы на слизистой оболочке). Признаки дилатации лимфатических сосудов, лучше визуализируются при скармливании жирной пищи перед проведением исследования.
Стратегия лечения PLE основывается на выборе адекватной нутрицептивной терапии и контроле уровня воспаления. В случае постановки диагноза на ранних стадиях диагностики, при выявлении очевидных патогенетических факторов (наличие в образцах кала простейших, яиц гельминтов или выявление возбудителей парво/ коронавирусного энтеритов в ректальных смывах), необходимо сосредоточить внимание на лечении выявленной патологий согласно действующим рекомендациям.
Животные поступившие с нестабильными показателями гемодинамики, в состоянии шока, нуждаются в проведении интенсивной терапии. Классический подход к проведению интенсивной терапии животным с гиповолемическим шоком (особенно в случае наличия выпота в анатомические полости или периферическими отеками мягких тканей, свидетельствующих о возможном низком онкотическом давлении), будет отличаться тем, что быстрое введение больших объемов кристаллоидов до введения коллоидов может быть необоснованным из-за низкого онкотического давления и неспособности вследствие этого удержать вводимый объем жидкости.
Болюсное введение кристаллоидов, в начале терапии, должно быть скорректировано в сторону уменьшения объемов и увеличения времени введения или должно проводиться максимально аккуратно при наличии лабораторно подтвержденных сведений о концентрации альбумина. Коллоидным раствором выбора, может являться волювен в дозировке 3мл/кг или альбумин 0.5-1г/кг в/в. В последующей терапии, также может потребоваться дополнительное введение альбумина, для поддержания онкотического давления крови. Многие пациенты поступают в состоянии от умеренной до выраженной дегидратации вследствие острой/хронической диареи и/или рвоты, и поэтому им, параллельно со стабилизацией гемодинамики, должна быть проведена адекватная инфузионная терапиия, направленная на регидратацию.

Проведение торакоцентеза, и удаление жидкости из грудной полости целесообразно в тех случаях, когда скопление ее значительных объемов, могут приводить к развитию дыхательной недостаточности. Назначение фуросемида в таких случаях нецелесообразно и может привести к усугублению дегидратации и снижению ОЦК. В некоторых случаях сильной анемии (RBC 2-3 х 1012/л Другие статьи
Читайте также:

