Эозинофилия у собак лечение
Опубликовано: 17.05.2024

Если домашний любимец заболел, хороший хозяин сразу отвезет его в ветеринарную клинику, чтобы исключить опасные заболевания. По внешним признакам далеко не всегда можно сказать, что приключилось с собакой. Более точные данные выдает анализ крови.
Иногда он показывает повышенное количество эозинофилов. Такое состояние называется эозинофилией.

Причины заболевания
Эозинофилы — это особые лейкоцитарные клетки крови, которые способны выходить за пределы кровеносной системы и накапливаться в пораженных органах, например, в пищеварительных органах, в дыхательной системе и коже, мягких тканях.
Эти клетки вырабатываются в кроветворной системе организма, большей частью концентрируются в периферической системе кровообращения и выполняют защитную функцию, борясь с паразитарными инфекциями и другими проблемами. Но слишком высокая концентрация эозинофилов зачастую провоцирует развитие гастритов и миозитов.
Причинами развития эозинофилии служат следующие заболевания и состояния:
- Сильный стресс.
- Физическое воздействие: травма, ожог, обморожение и так далее.
- Отравление.
- Гельминтозы.
- Аллергическая реакция.
- Бронхиальная астма и другие болезни органов дыхания.
- Сильные воспалительные процессы с образованием гноя.
- Болезнь Аддисона.
- Опухолевые процессы, особенно злокачественные новообразования.
- Рецидивирующие болезни.
Так как причин, вызывающих изменение уровня эозинофилов, много, то установить истинное заболевание можно только при тщательном обследовании.

Основные симптомы
Признаки эозинофилии напрямую связаны с заболеванием, ее спровоцировавшим. В основном выделяются следующие симптомы:
- увеличение печени и селезенки;
- анемии;
- увеличение лимфатических узлов;
- гастриты;
- расстройства пищеварения, диарея;
- тошнота, рвота;
- повышение температуры тела;
- признаки общей интоксикации — слабость, вялость, апатичное состояние;
- ухудшение аппетита;
- снижение массы тела;
- воспалительные состояния кровеносных сосудов;
- сухость и шелушение кожи;
- признаки кожных аллергических реакций;
- кашель;
- синюшность слизистых оболочек;
- признаки глистной инвазии и многое другое.
При обнаружении подобных признаков заболевшее животное нужно отвезти к ветеринару для постановки точного диагноза и начала лечения.
Диагностика в ветеринарной клинике
Чтобы установить уровень эозинофилов, в ветеринарной клинике животному сделают полный анализ крови. Но он только лишь укажет на наличие неблагополучия, а затем нужно будет пройти комплексное обследование для выявления основной причины изменения картины крови.

Методика лечения и прогноз
Чаще всего при эозинофилии у собаки развивается специфическая форма гастрита. Больше других этому заболеванию подвержены шарпеи и немецкие овчарки. Склонность к развитию такого заболевания усиливает неправильное питание с большим количеством синтетических продуктов, наличие гельминтозов, опухолевые процессы и наличие других проблем с пищеварительными органами.
Характерными признаками эозинофильного гастрита является сильная тошнота и постоянная рвота, которые при переходе в хроническое состояние приводят к сильнейшему ослаблению и истощению животного. В результате страдает и кожный покров, шерсть пса — они становятся сухими, хрупкими, поврежденными.
Собака не просто выглядит худой — у нее плохая, тусклая и выпадающая шерсть, явно нездоровый вид.
В тяжелых случаях и при истощении пса переводят на искусственное кормление в клинике, используют специальные препараты.
При наличии заболевания важную роль играет диетическое питание. Необходимо исключить аллергию на корма. При своевременной реакции и правильной терапии прогноз положительный.
Если же меры приняты поздно или лечение велось неправильно, без консультаций с опытным ветеринаром, риск развития осложнений и перехода болезни в хроническое состояние резко увеличивается. Болезнь ослабляет пса, в результате чего он становится мишенью для множества других заболеваний, особенно инфекционной природы.

Что делать в домашних условиях
Когда питомцу становится лучше, и его разрешают забрать домой, как любому выздоравливающему, ему необходимо обеспечить спокойные условия, тепло и уют. Животное будет ослабленным, возможно, истощенным, поэтому его нужно беречь от стрессов, сквозняков и переохлаждения.
Важную роль в выздоровлении играет правильное питание и любовь хозяев. Псу нужно обеспечить легкое, но калорийное питание, натуральные продукты, покой, достаточное количество чистой питьевой воды.
Полное выздоровление и нормализация картины крови может занять много времени.
Возможные осложнения
Вид осложнения зависит от основного заболевания. При нарушениях в органах дыхания собаке грозит тяжелая пневмония, бронхиальная астма и другие болезни. Аллергические реакции могут стать причиной выпадения шерсти, воспаления кожных покровов.
Проблемы с пищеварительной системой особенно неприятны, так как собака теряет вес, слабеет, не может нормально питаться, а на этом фоне может развиться множество опаснейших заболеваний.
Наибольшую угрозу несет эозинофилия на фоне злокачественных новообразований. Раковая опухоль может давать метастазы, что способно быстро стать причиной гибели домашнего любимца.

Меры профилактики (диета)
Избежать заболевания можно, если постараться обеспечить питомцу максимально здоровые условия жизни. В первую очередь это правильное питание натуральными продуктами. Чтобы не развился гастрит, спровоцированный пищевыми аллергиями, необходимо применять только качественные корма.
Если нет опыта составления собачьего меню, владельцам животного стоит обратиться за помощью к опытному ветеринару. Он составит оптимальный рацион с учетом породы, возраста собаки и наличия у нее тех или иных заболеваний.
Псу нужно обеспечивать регулярные прогулки и физическую активность. Важно вовремя проводить дегельминтизацию, так как глисты зачастую становятся причиной роста числа эозинофилов.
Полностью защититься от изменения картины крови невозможно, но уменьшить риск в силах хозяина пса.
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
- Биология возбудителя
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Основным источником инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена инвазионными яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Наибольший риск заражения у детей, страдающих геофагией. Взрослые заражаются при бытовом контакте с инвазированными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса паратенических хозяев. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка. Не исключается возможность трансплацентарной и трансмаммарной передачи инвазии и у человека.
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
- Клиническая картина токсокароза
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
- Диагностика
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
- Лечение токсокароза
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
- Профилактика
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
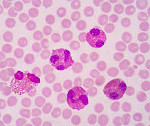
Эозинофилия (эозинофильный лейкоцитоз) – это увеличение в крови уровня эозинофилов больше 500 в 1 мкл крови или больше 5%. Чаще всего встречается при аллергических реакциях, паразитарных инвазиях, может свидетельствовать о тяжелых заболеваниях легких, онкологических гематологических патологиях. Специфических проявлений нет. Клиническая картина зависит от заболевания, при котором наблюдается повышенное содержание эозинофилов. Уровень эозинофилов исследуется в венозной или капиллярной крови путем подсчета лейкоцитарной формулы в общем анализе крови. Для коррекции эозинофилии необходимо лечение заболевания, которое ее вызвало.
Классификация
На сегодняшний день существуют две основные классификации эозинофилии – по уровню повышения эозинофилов и по этиопатогенетическому фактору. По количеству клеток различают следующие эозинофилии:
- Легкие. Уровень эозинофилов от 500 до 1500.
- Умеренные. Концентрация эозинофилов от 1500 до 5000.
- Выраженные. Содержание эозинофилов составляет более 5000. Наиболее характерны для гельминтозов, гематологических болезней.
Умеренные и выраженные эозинофилии объединяют термином гиперэозинофилии. По патофизиологическому механизму эозинофилии разделяют на:
- Клональные. Эозинофилы являются частью злокачественного клона. Встречаются при миелопролиферативных гемобластозах (лейкозах), системных заболеваниях тучных клеток (мастоцитозе).
- Реактивные. Общий механизм возникновения – гиперпродукция Т-хелперами интерлейкина-5, который стимулирует костномозговую выработку эозинофилов. Развиваются как ответная реакция на различные внешние воздействия на макроорганизм – аллергены, паразитарные инвазии и т.д. Составляют около 90% всех эозинофилий.
Отдельно выделяют транзиторную (кратковременную) эозинофилию, не связанную напрямую с конкретными заболеваниями. Количество эозинофилов может увеличиться при употреблении некоторых лекарственных препаратов (антибиотиков, противотуберкулезных средств), введении вакцины против гепатита А, при проведении гемодиализа, воздействии локальной радиационной терапии. Точный патофизиологических механизм повышения эозинофилов при этих обстоятельствах неизвестен.
Причины эозинофилии
Аллергии
Это наиболее частая причина эозинофилии. Любые реакции гиперчувствительности сопровождаются увеличением продукции эозинофилов костным мозгом. Патогенез эозинофилий при аллергиях хорошо изучен. При попадании в организм аллергена (ингаляционно, через кожу или слизистые) он взаимодействует с IgE на мембране базофилов. Это приводит к их дегрануляции последних и высвобождению гистамина, лейкотриенов и других медиаторов, в результате чего в тканях развивается аллергическое воспаление, что и обусловливает симптоматику со стороны кожи (атопический дерматит, крапивница), слизистых оболочек (аллергический ринит, конъюнктивит), а также дыхательной системы (бронхиальная астма).
Параллельно с этим базофилами выделяется эозинофильный хемотаксический фактор анафилаксии, который стимулирует миграцию эозинофилов из периферической крови к очагу воспаления. Эозинофилы, в свою очередь, подавляют выработку медиаторов аллергии. Во время разгара аллергической реакции (обострения) уровень эозинофилии максимальный; по мере разрешения симптомов он постепенно снижается и нормализуется в стадию ремиссии.
При выраженном обострении содержание эозинофилов, наоборот, может быть снижено (эозинопения) или даже равно нулю (анэозинофилия). Такое случается, когда произошла массивная миграция эозинофилов к очагу аллергического воспаления, а новые эозинофилы еще не успели синтезироваться в костном мозге. Также, если во время рецидива бронхиальной астмы присоединится вторичная бактериальная инфекция (бронхит), то показатели эозинофилов могут оставаться в пределах нормы.
В основном при аллергиях встречается легкая степень эозинофилии. Для бронхиальной астмы, особенно атопической и аспириновой формы, характерна умеренная эозинофилия. При аллергических патологиях повышенное содержание эозинофилов наблюдается не только в крови, но и в других биологических жидкостях (в мокроте и бронхоальвеолярной жидкости – при бронхиальной астме, в носовой слизи – при рините, в соскобе с конъюнктивы – при конъюнктивите).
Гельминтозы
Другой частой причиной эозинофилий (особенно среди детей) является заражение гельминтами. Эозинофилия в данном случае обусловлена двумя патогенетическими механизмами. Во-первых, эозинофилы обладают противопаразитарной активностью – они выделяют эозинофильный катионный белок и активные формы кислорода, которые губительны для гельминтов. Во-вторых, продукты метаболизма гельминтов способны индуцировать реакции гиперчувствительности. Именно поэтому глистные инвазии часто сопровождаются аллергической симптоматикой.
Самые частые гельминтозы, сопряженные с высокой эозинофилией среди детей – аскаридоз, токсокароз, среди взрослых ‒ анкилостомидоз, описторхоз. При стронгилоидозе эозинофильный лейкоцитоз долгое время может быть единственным проявлением. Эозинофилия выявляется уже на 4-5 день инфицирования. Затем она очень быстро нарастает и достигает максимума примерно к 30-40 дню, а потом медленно начинает уменьшаться, но продолжает оставаться на высоких цифрах длительное время. Уровень эозинофилов очень большой (может составлять от 20% до 70-80%). Резкое нарастание эозинофилии происходит во время стадии миграции личинок по организму и проникновения в ткани.
Заболевания легких
Существует группа болезней легких, называемых легочными эозинофилиями, которые объединяет большое содержание эозинофилов в крови, в бронхоальвеолярной жидкости и образование эозинофильных инфильтратов в легочной ткани. Точный патогенез эозинофилии периферической крови и инфильтрации эозинофилами легочной ткани при большинстве этих заболеваний неизвестен. Различают следующие легочные эозинофилии:
- Эозинофильные пневмонии. К ним относятся синдром Леффлера (простая легочная эозинофилия), острые, хронические эозинофильные пневмонии (ОЭП, ХЭП). При синдроме Леффлера наблюдается легкая эозинофилия, которая быстро и самостоятельно разрешается. Для ХЭП характерен постоянный умеренный эозинофильный лейкоцитоз. При ОЭП отмечается эозинофилия, резко нарастающая до высоких цифр (до 25%) и столь же стремительно регрессирующая на фоне терапии глюкокортикостероидами.
- Аллергический бронхолегочный аспергиллез. Обусловлен гиперчувствительностью больных к грибкам рода аспергилл. Патогенез сходен с аллергическими патологиями (IgE-опосредованная реакция). Эозинофилия умеренная, возникает только в фазу обострения. В период ремиссии уровень эозинофилов находится пределах нормальных значений.
- Синдром Черджа-Стросса. Эозинофильный гранулематоз с полиангиитом ‒ тяжелое заболевание неизвестной этиологии из ряда системных васкулитов, поражающее несколько внутренних органов. Эозинофильный лейкоцитоз наиболее высокий среди всех легочных эозинофилий, в период рецидива может доходить до 50%.

Болезни крови
Во время некоторых злокачественных гематологических заболеваний в крови наблюдается повышенный уровень эозинофилов с разным патогенетическим механизмом. При миелопролиферативных патологиях (остром и хроническом эозинофильном лейкозе, хроническом миелолейкозе), агрессивном системном мастоцитозе эозинофилия обусловлена опухолевой (клональной) пролиферацией эозинофильного ростка кроветворения.
Эозинофилия нарастает медленно, в течение нескольких лет. При мастоцитозе достигает умеренных значений, при лейкозах – выраженных (до 60-70%). Уменьшается очень медленно, под действием химиотерапии. Кроме периферической крови, эозинофилия наблюдается также в миелограмме (мазке пунктата костного мозга). Для лейкозов существует специфичный лабораторный признак ‒ одновременное увеличение эозинофилов и базофилов (базофильно-эозинофильная ассоциация).
При лимфогранулематозе и неходжкинских лимфомах эозинофилия возникает вследствие продуцирования лимфатическими клетками цитокинов (в том числе интерлейкин-5), которые стимулируют пролиферацию нормальных эозинофилов. Эозинофильный лейкоцитоз умеренный, медленно нарастающий.
Заболевания ЖКТ
Эозинофилия сопровождает некоторые болезни органов пищеварения. К ним относят эозинофильный эзофагит, гастрит и энтероколит. Морфологическим субстратом является инфильтрация эозинофилами стенок пищевода, желудка, кишечника. Патогенез до сих пор остается предметом дискуссий.
Предполагается, что у наследственно предрасположенных лиц воздействие пищевых аллергенов на слизистую оболочку вызывает активацию антиген-презентирующих клеток (Т-лимфоцитов), вырабатывающих интерлейкины и эотаксин-3. В результате этого происходит миграция эозинофилов и инфильтрация ими слизистой оболочки органов ЖКТ. Эозинофильный лейкоцитоз обычно легкий и наблюдается только во время выраженного обострения заболевания. Высокая концентрация эозинофилов в биоптате слизистых, напротив, встречается постоянно.
Эндокринопатии
Некоторые гормоны, например, глюкокортикостероиды (гормоны коры надпочечников), стимулируют апоптоз (запрограммированную клеточную гибель) эозинофилов. Поэтому заболеваниям, сопровождающимся снижением уровня глюкокортикостероидов, сопутствует эозинофилия. К таким патологиям относятся первичная надпочечниковая недостаточность (болезнь Аддисона), врожденная дисфункция коры надпочечников, а также множественные эндокринопатии, такие как синдром Шмидта, пангипопитуитаризм. Степень эозинофилии легкая. Количество эозинофилов быстро нормализуется после введения глюкокортикоидов.
Иммунодефицитные состояния
Эозинофилия встречается при, так называемых, первичных иммунодефицитах – тяжелых болезнях с высокой летальностью, обусловленных генетическим дефектом одного или нескольких компонентов иммунной системы (клеточных, гуморальных реакций, фагоцитоза и пр.). Такими заболеваниями являются синдром Вискотта-Олдрича и синдром Джоба (гипер-IgE-синдром). Эозинофилия, вероятно, связана с аномальной гиперпродукцией иммуноглобулина Е. Уровень эозинофилов в тканях и крови очень высокий (до 60%), не поддается коррекции.
Злокачественные новообразования
Некоторые опухоли, особенно аденокарциномы легких, органов пищеварительной и мочеполовой системы, имеют способность к выработке эозинофильного хемотаксического фактора, стимулирующего костномозговую продукцию эозинофилов. При таких заболеваниях эозинофильный лейкоцитоз нарастает медленно, достигает высоких значений (до 20-40%). Концентрация эозинофилов периферической крови возвращается к норме после долгой химиотерапии или хирургического удаления злокачественного образования.
Диагностика
Эозинофилия выявляется при подсчете лейкоцитарной формулы клинического анализа крови. Так как спектр патологий, сопровождающихся эозинофилией, довольно широк, при впервые выявленных изменениях в анализах необходимо обратиться к врачу-терапевту. Для подтверждения заболевания, вызвавшего эозинофилию, с учетом клинических и анамнестических данных назначается обследование, которое может включать:
- Анализы крови. Определяется уровень эритроцитов, лейкоцитов, тромбоцитов. Проверяется наличие специфических антител к гельминтам, грибкам, антицитоплазматических антител (ANCA), концентрация некоторых гормонов (кортизола, паратгормона, эстрогенов, андрогенов). Проводится генетическое исследование на первичные иммунодефициты, а также иммунофенотипирование, иммуногистохимический анализ клеток крови для обнаружения специфических опухолевых антигенов (CD-маркеров).
- Аллергодиагностика. Для выявления аллергена выполняются различные аллергопробы – кожные (скарификационные, аппликационные, прик-тесты), провокационные (назальные, ингаляционные, конъюнктивальные), прямой и непрямой базофильный тесты. Методом ИФА измеряется уровень иммуноглобулина E (IgE).
- Исследование мокроты. Осуществляется микроскопическое исследование мокроты для изучения клеточного состава (количества эозинофилов, наличия кристаллов Шарко-Лейдена, спиралей Куршмана), выявления личинок гельминтов. Проводится бактериологический, микологический посев мокроты с определением чувствительности к антибактериальным и противогрибковым препаратам.
- Рентгенологические исследования. Одним из наиболее информативных методов диагностики легочных эозинофилий считается рентгенография грудной клетки. На снимках обнаруживаются летучие (мигрирующие) эозинофильные инфильтраты в виде участков затемнения. При аллергическом бронхолегочном аспергиллезе могут быть видны бронхоэктазы, фиброз верхних отделов легких.
- Эндоскопия. При подозрении на эозинофильное поражение органов желудочно-кишечного тракта проводятся фиброгастродуоденоскопия и фиброколоноскопия со взятием биопсийного материала. Для морфологической картины, помимо эозинофильной инфильтрации, характерен фиброз собственной пластинки слизистой оболочки.
- Спирометрия. При поражении дыхательной системы выполняется оценка функции внешнего дыхания. Измеряется степень проходимости бронхов мелкого и среднего калибра, растяжимость легочной ткани. Для пациентов с бронхиальной астмой типично уменьшение объема выдыхаемого воздуха (индекс Тиффно) и улучшение дыхательной функции после фармакологической пробы с сальбутамолом. При легочных эозинофилиях наблюдается снижение жизненной емкости легких.
- Гистология. С целью подтверждения синдрома Черджа-Стросса берется биопсия легкого. Отмечаются периваскулярные эозинофильные инфильтраты. Для изучения морфологической картины костного мозга (в случае подозрения на лейкоз) прибегают к стернальной пункции и трепанобиопсии. Обнаруживаются гиперплазия гранулоцитарного ростка кроветворения, гиперклеточность за счет эозинофильных миелобластов.

Коррекция
Самостоятельная коррекция эозинофилии невозможна. Для нормализации уровня эозинофилов необходимо бороться с причиной. Если эозинофилия легкая, связана с приемом ЛС или вакцинацией либо приходится на период реконвалесценции – беспокоиться не стоит. Нужно понаблюдать кровь в динамике через 7-10 дней. При обнаружении стойкой или высокой эозинофилии в анализе крови следует обратиться к специалисту, чтобы тот на основании осмотра, жалоб, анамнеза провел диагностический поиск этиологического фактора и назначил соответствующее лечение. Для терапии большинства болезней, сопровождающихся эозинофилией, используются лекарственные препараты из группы антигистаминных средств или глюкокортикостероидов.
Прогноз
Только по одному лишь эозинофильному лейкоцитозу в крови невозможно предсказать риск возникновения тех или иных последствий для здоровья и жизни человека. Прогноз всегда определяется основным заболеванием и своевременностью его диагностирования – он может варьироваться от благоприятного при аллергическом конъюнктивите до высокой вероятности летального исхода при злокачественных новообразованиях или миелопролиферативных патологиях. Поэтому любое превышение референсных значений эозинофилов в клиническом анализе крови требует тщательного обследования для установления причины.
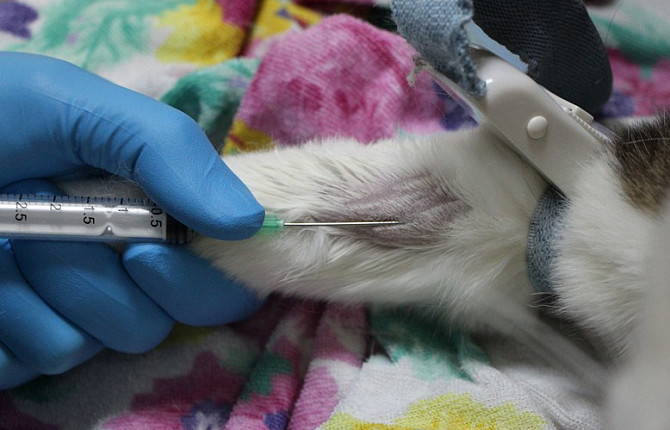
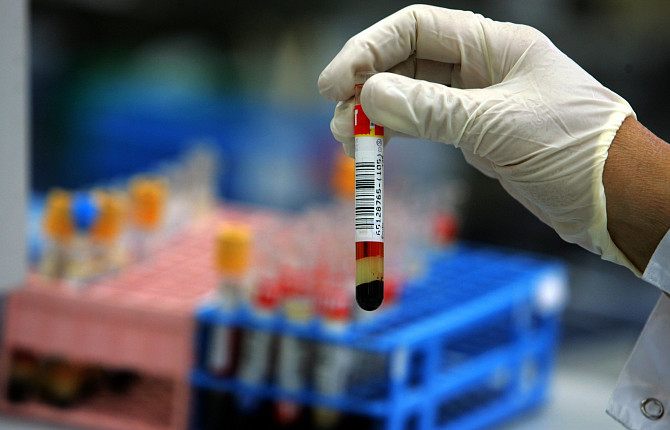
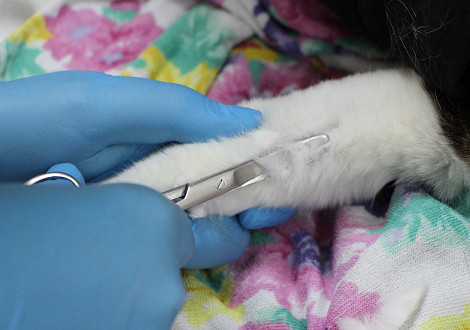
Общий анализ крови является одним из основных методов диагностики состояния животного. В нем определяют такие показатели, как общее число лейкоцитов, эритроцитов и тромбоцитов, а также гематокрит, гемоглобин, средний объем эритроцитов, среднее содержание и концентрацию гемоглобина в эритроците.
Лейкоциты – белые кровяные тельца. Это клетки сосудистой системы крови, разнообразные по морфологии и функциям. Лейкоциты образуются в костном мозге.
Лейкоциты защищают организм от инфекций путем фагоцитарной активности, то есть они поглощают чужеродные клетки. Также они участвуют в формировании гуморального иммунитета (образование антител лимфоцитами) и в восстановительном процессе при тканевом повреждении.
По морфологии лейкоциты делятся на 2 группы, клетки которых отличаются по внешнему виду и выполняемым функциям:
Гранулоциты – клетки, в цитоплазме которых содержится специфическая зернистость. К ним относятся нейтрофилы, эозинофилы, базофилы.
Агранулоциты – клетки, характеризующиеся отсутствием специфической зернистости в цитоплазме и несегментированными ядрами. К данной группе относятся лимфоциты и моноциты.
В общем анализе крови определяется общая концентрация лейкоцитов крови и процентное соотношение основных субпопуляций лейкоцитов.
Лейкоцитарная формула (лейкограмма) – процентное (или абсолютное) соотношение различных видов лейкоцитов. Лейкоцитарная формула подсчитывается в окрашенном мазке крови под микроскопом.
В клинической практике лейкограмма имеет большое значение, так как при изменениях в организме содержание одних видов лейкоцитов увеличивается или уменьшается за счет изменения количества других.
Эозинофилы – клетки крови размером 8 – 20 мкм. Вся их цитоплазма заполнена крупной зернистостью розового цвета, так как при окраске по Романовскому эозинофилы интенсивно окрашиваются кислым красителем эозином. Ядро эозинофилов состоит из 2 долей. Эозинофилы относятся к гранулоцитарным лейкоцитам. У разных видов животных гранулы различаются по внешнему виду. Например, у собак они имеют круглую форму и отличаются по размеру и количеству в цитоплазме. У кошек зерна имеют палочковидную форму и заполняют всю цитоплазму.
Эозинофилы обладают некоторой фагоцитарной и двигательной активностью, участвуют в аллергических реакциях. Они являются микрофагами, то есть поглощают мелкие чужеродные частицы и клетки. Эозинофилы способны к активному амебоидному движению. Они проникают за пределы стенок кровеносных сосудов. Также свойством этих клеток является хемотаксис – движение в направлении очага воспаления или поврежденной ткани. Большая часть эозинофилов недолго остается в крови. Затем они мигрируют в ткани, где находится длительное время.
Основная функция эозинофилов – борьба с паразитами и участие в аллергических реакциях. Они нейтрализуют избыток гистамина, который выделяется в большом количестве при аллергии. Участвуют в переносе продуктов распада белков, обладающих антигенными свойствами, и предупреждают местное скопление большого количества антигенов. Следовательно, при аллергических реакциях эозинофилы связывают и переносят антигены и гистамин к обезвреживающим органам (печень). Также эозинофилы способны при необходимости высвобождать гистамин для предупреждения аллергической реакции.
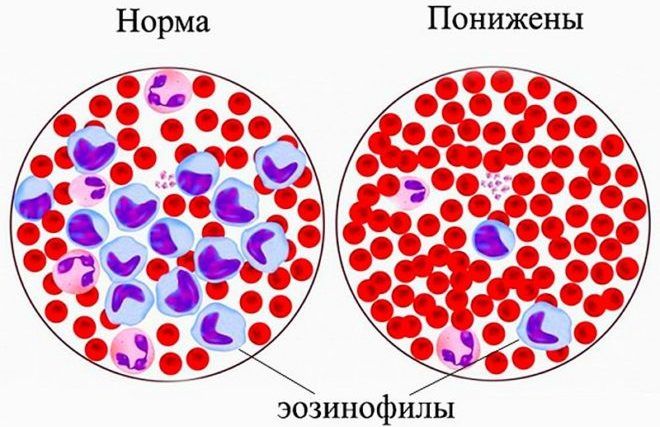
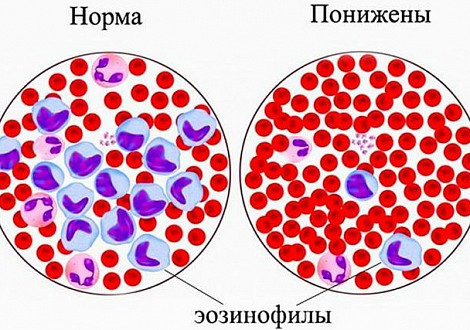
В крови содержится небольшое количество эозинофилов. Повышение их уровня называется эозинофилией, уменьшение – эозинопенией.
Причины эозинофилии:
Паразитарные заболевания (например, аскаридоз, описторхоз, трихинеллез).
Аллергические заболевания (бронхиальная астма, аллергический дерматит, аллергия на лекарственные препараты, пищевая аллергия).
Злокачественные новообразования (лимфогранулематоз, хронический миелолейкоз и другие). Особенно характерно для опухолей, сопровождающихся метастазами и некрозом.
Болезни соединительной ткани (ревматоидный артрит).
Эозинопения – понятие относительное. Может наблюдаться у здоровых животных. В некоторых случаях встречается при сепсисе, травмах, ожогах. Также снижение эозинофилов характерно для начальной фазы инфекционно-токсического процесса. Благоприятным симптомом является появление эозинофилов в крови во время острого инфекционного заболевания. Это признак того, что начинается выздоровление.
Если вы заметили изменение в состоянии домашнего животного, обратитесь за консультацией к врачу-терапевту.
Хронический эозинофильный лейкоз (ХЭЛ) является миелопролиферативным новообразованием, при котором вследствие неконтролируемой клональной пролиферации предшественников эозинофилов, возникает эозинофилия в костном мозге, периферической крови и тканях. Согласно классификации ВОЗ (2008) из этой нозологической единицы (называемой с тех пор ХЭЛ, не специфицированный иным образом [ХЭЛ НИО]) исключены случаи с мутациями генов PDGFRA .
Гиперэозинофилия (ГЭ) это наличие особенно высокой эозинофилии в периферической крови (>1500/мкл) и/или эозинофильной инфильтрации в тканях; в случае повреждения органов используется термин «гиперэозинофильный синдром» (ГЭС). ГЭ/ГЭС может иметь доброкачественный характер (реактивный, врожденный или идиопатический) или неопластический (клональный).
КЛИНИЧЕСКАЯ КАРТИНА И ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ наверх
На момент постановки диагноза больные обычно не предъявляют никаких жалоб.
1. Общие симптомы: возникают из-за высвобождения эозинофилами большого количества цитокинов — усталость, лихорадка и потливость, отсутствие аппетита, потеря массы тела.
2. Симптомы со стороны системы кровообращения (у ≈20 %): связаны с некрозом и фиброзированием сердечной мышцы и эндокарда, а также возникновением пристеночных тромбов в полостях сердца — симптомы недостаточности клапанов, обычно митрального и трикуспидального, симптомы рестриктивной кардиомиопатии, нарушения ритма и проводимости, тромбоэмболические осложнения, сердечная недостаточность.
3. Симптомы со стороны дыхательной системы (у ≈50 %): связаны с эозинофильными инфильтратами в легких, фиброзом легких, сердечной недостаточностью или легочной эмболией — хронический сухой кашель, одышка.
4. Кожные симптомы (у ≈60 %): ангионевротический отек, покраснение кожи, крапивница, папулы и подкожные узелки, зуд кожи.
5. Симптомы со стороны пищеварительного тракта (у ≈30 %): связаны с язвами слизистой оболочки, кровотечением, перфорацией, холециститом, эозинофильным воспалением желудка или кишечника; диарея, боль в животе.
6. Неврологические симптомы (у ≈55 %): изменения поведения, расстройства памяти, атаксия, симптомы периферической полинейропатии.
7. Другие: увеличение печени или селезенки, боль в мышцах и суставах (вызванная высвобождением эозинофилами провоспалительных цитокинов), нарушение зрения (связанное с тромбозом сосудов сетчатки).
8. Естественное течение: хроническое, иногда легкое, однако чаще всего прогрессирует и может в течение короткого времени привести к смерти вследствие органных поражений, обычно сердечной недостаточности или в результате трансформации в острый лейкоз.
Дополнительные методы исследования
1. Морфология периферической крови: эозинофилия (абсолютное число эозинофилов: легкая 500–1500/мкл; умеренная 1500–5000/мкл, тяжелая >5000/мкл), при ХЭЛ дополнительно анемия (≈50 %), тромбоцитопения (≈30 %) или тромбоцитоз (≈15 %), умеренный лейкоцитоз.
2. Аспирационная биопсия и трепанобиопсия костного мозга: показаны у больных с персистирующей ГЭ неустановленной этиологии, эозинофилией >5000/мкл, в случае подозрений на первичную (неопластическую) ГЭ/ГЭС или лимфоцитарный вариант ГЭС; аспирационная биопсия — увеличен процент эозинофилов, иногда диспластические изменения в мегакариоцитах и гранулоцитах; трепанобиопсия — гиперклеточность, увеличено количество эозинофилов, гиперплазия мегакариоцитарного или гранулоцитарного ростка, увеличение количества ретикулярных волокон.
3. Цитогенетические и молекулярные исследования: при ХЭЛ в большинстве случаев присутствует слитный ген FIP1L1-PDGFRFА , который возник вследствие делеции фрагмента 4 хромосомы и кодирует белок с активностью тирозинкиназы.
4. Другие лабораторные исследования: увеличенная концентрация IgE при идиопатической эозинофилии, при ХЭЛ-НИО — обычно нормальная; увеличенная концентрация сердечных тропонинов, триптазы и витамина B 12 при неопластических ГЭС.
5. Гистологическое исследование биоптатов органов, вовлеченных в патологический процесс: эозинофильные инфильтраты.
6. Другие исследования: в зависимости от клинической картины (вовлеченных органов), а также для определения причины эозинофилии.
→Определение и этиопатогенез
Диагноз ХЭЛ ставится в соответствии с критериями ВОЗ:
1) эозинофилия ≥1500/мкл;
2) наличие цитогенетических или молекулярно-генетических аномалий, или количество бластов >5 % в костном мозге или >2 % в периферической крови;
3) отсутствие Ph-хромосомы и химерного гена BCR-ABL1 , а также иного миелопролиферативного (ИП, ЭТ, ПМФ) или миелодиспластического/миелопролиферативного (ХММЛ, аХМЛ) новообразования;
4) отсутствие перестроек генов PDGFRА , PDGFRВ или FGFR1 , отсутствие химерного гена PCM1-JAK2 , ETV6-JAK2 и BCR-JAK2 ;
5) процентное количество бластов в периферической крови и костном мозге 1. ГЭ/ГЭС первичные: эозинофилы являются частью неопластического клона (миелопролиферативные опухоли, ОМЛ).
2. ГЭ/ГЭС вторичные (реактивные): паразитарные заражения (особенно гельминтозы), аллергические реакции, реакции на лекарства (аллергические или токсические); более редкие причины: легочные эозинофилии →разд. 3.14.5, болезнь трансплантат против хозяина, лимфома Ходжкина, лимфомы периферических Т-клеток (PTCL), гистиоцитоз клеток Лангерганса, системный индолентный мастоцитоз, солидная опухоль, аллергический бронхолегочный аспергиллез, хронические воспалительные заболевания (напр. кишечника), системные заболевания соединительной ткани (эозинофильный гранулематоз с васкулитом [в прошлом синдром Черджа-Стросса], другие системные васкулиты, глубокий эозинофильный фасциит с эозинофилией).
3. Заболевания пораженных при ГЭС →см. выше.
1. Больные с количеством эозинофилов не нуждаются в экстренной циторедукции.
2. ХЭЛ с геном FIP1L1-PDGFRA и реаранжировкой гена PDGFRB : иматиниб. У пациентов с сердечной недостаточностью в течение первых 7–10 дней лечения иматинибом используйте ГКС, чтобы избежать ухудшения состояния функции сердца, вызванного массовым освобождением токсичных белков из гранул эозинофилов.
3. ГЭС без перестановки PDGFRA и PDGFRB : ГКС, напр., преднизон 1 мг/кг массы тела до времени уменьшения количества эозинофилов до пределов нормы и исчезновения симптомов, затем медленно уменьшайте дозу, устанавливая самую низкую эффективную поддерживающую дозу. При реактивном ГЭС → следует лечить основное основное заболевание.
4. В случае неэффективности и при ХЭЛ-БДУ: цитостатики (гидроксимочевина, в случае неэффективности → ИНФ-α, в последствии винкристин или этопозид; → в случае неэффективности → экспериментальное лечение (меполизумаб, алемтузумаб) или алло-ТГСК.
Общий анализ крови (количество эозинофилов должно составлять FIP1L1-PDGFRA ) каждые 3 месяца.
Эозинофилия >5000/мкл, независимо от этиологии, несет высокую угрозу необратимого повреждения органов, в связи с чем необходимо быстро применить терапию. Большинство больных с идиопатическим ГЭС хорошо реагируют на лечение ГКС в монотерапии или в сочетании с гидроксимочевиной, а больные устойчивые к этим лекарствам реагируют на остальные вышеупомянутые методы лечения (процент 5-летнего выживания до 90 %). У больных с ХЭЛ и наличием гена FIP1L1-PDGFRA очень хороший ответ на лечение иматинибом. Прогноз при ХЭЛ-НИО неблагоприятный — у половины больных происходит трансформация в AML/ОМЛ, а среднее время выживания составляет 22 мес.
Читайте также:

