Лечение панникулита у собак
Опубликовано: 06.05.2024
Особенности
Стерильный узелковый панникулит собак и кошек является редко встречающимся идиопатическим воспалительным заболеванием подкожной жировой клетчатки. Поражения характеризуются одним или несколькими глубоко расположенными подкожными узелками, которые могут иметь размер от нескольких миллиметров до нескольких сантиметров в диаметре. Эти узелки могут быть болезненными и флюктуирующими или твердыми; они могут изьязвляться и могут образовываться свищи с желтоватым, маслянистым экссудатом. Поражения могут находиться в любом участке тела, а у некоторых собак могут прогрессировать и регрессировать. Одновременно могут наблюдаться лихорадка, анорексия и депрессия.
Дифференциальные диагнозы
Дифференциальные диагнозы включают инфекцию (бактериальную, микобактериальную, грибковую), реакцию на инородное тело, реакцию на лекарственный препарат, постиньекционную реакцию, системную красную волчанку, неоплазию и дефицит витамина Е (стеатит у кошек).
Диагноз
1 Исключите другие дифференциальные диагнозы.
2 Цитология (аспират): нейтрофилы и пенистые (липидсодержащие ) макрофаги. Микроорганизмы не обнаруживаются.
3 Дерматогистопатология (эксцизионная биопсия): гнойный, пиогранулематозный, гранулематозный, эозинофильный, некротизирующий или фиброзирующий септальный или диффузный панникулит. Специальное окрашивание не выявляется инфекционных агентов.
4 Микробные культуры (ткани), полимеразная цепная реакция и серология: негативная для анаэробных и аэробных бактерий, микобактерий и грибков.
Лечение и прогноз
1 Если поражение единичное, то полное хирургическое удаление обычно приводит к выздоровлению.
2 Для лечения и профилактики вторичной пиодермии у собак должна быть назначена соответствующая долговременная системная антибиотикотерапия (минимум 4 недели). Собаки, которым проводилась антибиотикотерапия в течение индукционной фазы иммуносупрессивной терапии, имели значительно более высокие показатели выживаемости, чем собаки, которые лечились только иммуносупрессивными препаратами. Лечение антибиотиками должно продолжаться до того, как лечение иммуносупрессивными препаратами возьмет аутоиммунное заболевание под контроль.
3 Целью лечения является контроль заболевания и его симптомов при использовании самых безопасных методов лечения с возможно наименее низкими дозами лекарственных препаратов. Обычно целеобразно применение комбинаций препаратов (см табл 8-1), для того, чтобы обеспечить комплексное лечение, минимизируя побочные эффекты какого –то одного вида лечения. В зависимости от тяжести заболевания должны быть выбраны более или менее агрессивные методы лечения. Для того, чтобы добиться ремиссии заболевания первоначально используются более высокие дозы, которые затем постепенно в течение 2-3 месяцев уменьшаются до достижения наименьших эффективных доз.
Методы консервативного системного лечения (см табл 8-1) включают лекарственные препараты, которые помогают снизить выраженность воспаления с минимумом или отсутствием побочных эффектов. Эти методы лечения помогают снизить необходимость более агрессивных методов лечения, таких как стероиды или химиотерапевтические препараты.
Стероидная терапия является одним из наиболее надежно прогнозируемых методов лечения аутоиммунного заболевания кожи; однако, побочные эффекты, ассоциированные с высокими дозами, необходимыми для контроля симптомов, могут быть тяжелыми. Хотя глюкокортикоидная терапия в монорежиме может быть эффективна для поддержания ремиссии, дозы, необходимые для этого, могут приводить к нежелательным побочным эффектам, особенно у собак. По этой причине использование нестероидных иммуносупрессивных лекарственных препаратов, как в монорежиме, так и в комбинации с глюкокортикоидами, обычно рекомендуется для долговременного поддерживающего лечения.
- Иммуносупрессивные дозы орального преднизолона или метилпрпеднизолона должны назначаться ежедневно (см табл 8-1). После исчезновения поражений (после ≈2–8 недель) дозы должны постепенно уменьшаться в течение нескольких (8–10) недель до достижения наименее возможной дозы через день, которая поддерживает ремиссию. Если не наблюдается значительного улучшения в течение 2-4 недель после начала лечения, должна быть исключена одновременно имеющаяся инфекция кожи и затем рассмотрены альтернативные или дополнительные иммуносупрессивные препараты.
- Альтернативные стероиды для случаев, рефрактерных к преднизолону или метилпреднизолону, включают триамцинолон и дексаметазон (см табл 8-1).
- У кошек лечение иммуносупрессивными дозами триамцинолона или дексаметазона часто более эффективно, чем терапия преднизолоном или метилпреднизолона. Оральный триамцинолон или дексаметазон должны назначаться ежедневно до достижения ремиссии (≈2–8 недель), и затем доза должна постепенно уменьшаться до наименее возможной с наименее частым применением, поддерживающим ремиссию (см табл 8-1).
- Если развиваются неприемлемые побочные эффекты или не наблюдаются значительное улучшение в течение 2-4 недель после начала лечения, рассмотрите использование альтернативного глюкокортикостероида или нестероидного иммуносупрессирующего лекарственного препарата (см табл 8-1).
4 Прогноз после лечения хороший, хотя после лечения могут оставаться рубцы в местах поражений.
Фото 1. Стерильный узловой панникулит собак и кошек. Множественные узелки на туловище этого молодого лабрадора медленно увеличивались и в итоге появились свищи.
Фото 2. Стерильный узловой панникулит собак и кошек. Узелки с облысением и свищами на поясничной области у взрослой таксы.
Фото 3. Стерильный узловой панникулит собак и кошек. Множественные узелки и свищи на спине.
Фото 4. Стерильный узловой панникулит собак и кошек. Узелок с облысением на туловище собаки до его разрыва и появления свища.
Фото 5. Стерильный узловой панникулит собак и кошек. Разорванный узелок со свищом, из которого выделяется серозногеморрагическая жидкость, которая создает корки.
Фото 6. Стерильный узловой панникулит собак и кошек. Узелковые поражения часто сопровождаются свищами, из которых выделяется прозрачная маслянистая жидкость
Фото 7. Стерильный узловой панникулит собак и кошек. Узелки с облысением на туловище.
Фото 8. Стерильный узловой панникулит собак и кошек. Большой узел в области лопатки со свищеванием (черные стрелки). Белая стрелка указывает на второй подкожный узелок, находящийся между пальцами.
Фото 9. Стерильный узловой панникулит собак и кошек. Большой эритематозный плотный узел.
Фото 10. Стерильный узловой панникулит собак и кошек. Два шприца с геморрагическим аспиратом из стерильного узелкового поражения.
Фото 11. Стерильный узловой панникулит собак и кошек. Три зоны алопеции с рубцеванием, одна из которых гиперпигментирована, а две других гипопигментированы, у таксы, выздоравливающей от панникулита.
Фото 12. Стерильный узловой панникулит собак и кошек. Цитологический образец, демонстрирующий вакуоли, содержащие жир, мононуклеарные клетки, ДНК с дегенерацией и воспалительные клетки.
Фото 8-12 из руководства Small Animal Dermatology Muller and Kirk’s 2013г

У собак большинство гранулематозных или пиогранулематозных поражений кожи появляются в виде папул, узелков и / или бляшек. Поражения могут быть единичными или множественными, локализованными или генерализованными. Они также могут быть алопеционными или с волосами, с изъязвлениями, твердыми или колеблющимися, и могут варьироваться в размерах от нескольких миллиметров до нескольких сантиметров. Причины возникновения гранулематозного дерматита у собак и кошек разнообразны и многочисленны: поражения могут быть связаны с инфекционными агентами, такими как бактерии, водоросли, грибы, паразиты и простейшие, или неинфекционными агентами, такими как инородные тела; также сообщалось о идиопатических факторах. Микроскопически, узелковый и / или диффузный, гранулематозный и пиогранулематозный дерматит обычно проявляется у собак, но в меньшей степени у кошек. Он характеризуется многоочаговым узловым воспалением дермы, которое имеет тенденцию к слиянию или диффузному рисунку. Кожные «стерильные пиогранулемы / гранулемы являются идиопатическим, редким заболеванием кожи у собак. Патогенез неизвестен, но гистологическая картина воспалительного инфильтрата, исключение различных возбудителей и хорошая или отличная реакция на глюкокортикоиды и другие иммуномодулирующие препараты подтверждают, что это является иммуноопосредованное расстройство. Однако было выдвинуто предположение, что это может быть связано с иммунным ответом против постоянных эндогенных или экзогенных антигенов, таких как Leishmania sp. и / или Mycobacterium sp., вызывающие гранулематозную воспалительную реакцию.
Клинические проявления характеризуются плотными, покрытыми волосами или частично алопециальными, эритематозными папулами, узелками или бляшками. Чаще всего поражаются участки головы (главным образом, переносицы, морды и периокулярной области) и дистальных конечностей, реже - ушные раковины, глаза, туловище (боковой и спинной стороны) и брюшная полость. В большинстве случаев поражения являются множественными и без боли или зуда. Также сообщалось о возможной лимфаденопатии. Системные признаки, связанные с этим синдромом, не сообщались.
Диагностика основана на клиническом проявлении, гистопатологических данных, исключении микроорганизмов с использованием специальных методов окраски (PAS, Ziehl-Neelsen и Gram). Также в последствии гистологические срезы окрашивались специальными красками, для обнаружения таких микроорганизмов, которые невозможно увидеть при стандартном окрашивании (Leishmania spp. и Mycobacterium spp.).
Наиболее часто используемое лечение, заключается в хирургическом удалении одиночных узелков или бляшек или системных лекарств от множественных поражений, включая иммунодепрессивную дозу глюкокортикоидов и применение тетрациклина и ниацинамида или азатиоприна в случаях, когда поражения не реагируют на глюкокортикоиды. Также сообщалось, что применение антибиотиков уменьшает воспаление в случае вторичной бактериальной инфекции . Более конкретно, было показано, что комбинация тетрациклина и ниацинамида обладает синергетическим эффектом и многочисленными иммуномодулирующими свойствами, хотя механизм их действия при иммуноопосредованных заболеваниях до конца не изучен. Фактически, тогда как тетрациклин способен ингибировать выработку антител in vitro, активацию комплимента, синтез простагландинов и функцию липаз и коллагеназ, а иасинамид обладает способностью in vitro и in vivo предотвращать дегрануляцию тучных клеток, ингибировать фосфодиэстеразы и уменьшение высвобождения протеаз, их сочетание продемонстрировало способность ингибировать бластную трансформацию лимфоцитов и хемотаксис нейтрофилов и эозинофилов. Комбинация тетрациклин / ниацинамид используется в дозе 250 мг для собак весом менее 10 кг и 500 мг для собак весом более 10 кг.
Патогенный механизм роста и ослабления или клиническое разрешение не известны. Возможно, что прекращение аномального иммунологического ответа на возможный хронический стимул является основой для этого явления.
Заражение Leishmania sp. может имитировать клинические и гистопатологические данные синдром гранулемы и особенно важно исключить лейшманиоз, если он является эндемичным в этой области. При собачьем лейшманиозе узелки и / или бляшки появляются примерно в 6% кожных поражений в результате гистиоцитарной реакции против простейших и могут наблюдаться при цитологическом и / или гистологическом исследовании.
Точно так же синдром лепроидной гранулемы у собак может быть клинически и гистопатологически охарактеризован гранулематозным / пиогранулематозным дерматитом , а в некоторых случаях специальные методы окрашивания, такие как Ziehl – Neelsen, могут давать отрицательные результаты даже в присутствии микроорганизмов. В этих случаях использование ПЦР необходимо, чтобы однозначно исключить микобактериальные инфекции.
Узелковые поражения у собак являются диагностической проблемой для ветеринара. Этот вид поражения у взрослых и старых собак с лимфаденопатией или без нее должен предупреждать клинициста о неоплазии и / или иммуноопосредованных нарушениях (гистиоцитоз, лейшманиоз, атипичная микобактериальная гранулема и стерильный нодулярный дерматит). Для изучения этиологии этого кожного заболевания необходимы многопрофильные исследования в больших популяциях.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Панникулит спонтанный (синонимы: болезнь Вебера-Крисчена, гиподермит атрофический).
Причины и патогенез панникулита спонтанного до конца не изучены. Важное значение имеют перенесенные инфекции, травма, лекарственная непереносимость, поражения поджелудочной железы и др. Определенную роль играют процессы перекисного окисления липидов. Выявлено усиление этих процессов в патологическом очаге и снижение антиоксидаптпой активности организма. Отмечается дефицит а-антитрипцилина (а-АНТ) - ингибитора плазменных протеаз. а-АНТ контролирует развитие воспалительных реакций.
Симптомы панникулита спонтанного. Заболевание чаще встречается у женщин. Начинается оно обычно с недомогания, болей в мышцах и суставах, головной боли, повышения температуры тела до 37- 40 °С. Иногда болезнь начинается и протекает без нарушения общего состояния больного. Характерно появление единичных уши множественных подкожных узлов. Процесс может иметь диссеминированный характер. Узлы сливаются в конгломераты различного размера, образуя на поверхности обширные бляшки с неровной бугристой поверхностью и расплывчатыми границами. При классическом течении узлы обычно не вскрываются, при рассасывании на их месте остаются участки атрофии или западения. Иногда на поверхности отдельных узлов или конгломератов появляется флюктуация, узлы вскрываются, выделяя желтоватую пенистую массу. Кожа над узлами имеет нормальную окраску или приобретает ярко-розовый цвет. Наиболее часто узлы располагаются на нижних и верхних конечностях, ягодицах, но могут локализоваться и на других участках.
Клинически различают три формы кожных проявлений спонтанного панникулита: узловатую, бляшечную и инфилыпративную.
Узловатая форма характеризуется образованием узлов диаметром от нескольких миллиметров до нескольких сантиметров. В зависимости от глубины расположения в подкожной клетчатке они имеют ярко-розовую или розово-синюшную окраску, располагаются изолированно друг от друга, не сливаются, четко отграничены от окружающей ткани.
Бляшечная форма образуется в результате слияния узлов в конгломераты, которые занимают обширные поверхности голени, бедра, плеча и т. д. В этом случае могут отмечаться отек конечности и выраженная боль вследствие сдавления сосудисто-нервных пучков. Поверхность очагов поражения бугристая, границы расплывчаты, консистенция плотноэластическая (склеродермоподобная). Цвет кожи в очагах поражения варьирует от розового до синюшно-бурого.
При инфильтративной форме на поверхности отдельных узлов или конгломератов появляется флюктуация, цвет очагов становится ярко-красным или багровым. Клиническая картина напоминает абсцесс или флегмону. При вскрытии очагов обнаруживают желтоватую пенистую массу.
У одного больного одновременно могут встречаться различные формы или одна форма может перейти в другую.
В зависимости от выраженности клинического течения выделяют хроническую, подострую и острую формы.
При остром течении отмечаются выраженные общие симптомы заболевания: лихорадка длительного гектического типа, слабость, лейкопения, повышенная СОЭ; отклонение биохимических констант организма. Клинически данная форма характеризуется быстрой сменой ремиссий и рецидивов, торпидностью и резистентностью к различным видам терапии. Число узлов на коже обычно увеличивается. При подострой форме клинические признаки выражены слабее.
Хроническая форма спонтанного панникулита имеет благоприятное течение, общее состояние больных обычно не нарушено, ремиссии продолжаются долго, но рецидивы протекают тяжело. Изменения во внутренних органах отсутствуют.
Гистопатология. Гистологические изменения характеризуются инфильтрацией жировой клетчатки лимфоцитами, сегментоядерными нейтрофилами, без образования абсцессов. По мере развития патологического процесса инфильтрат, состоящий из гистиоцитов с примесью плазматических клеток и лимфоцитов, замещает целые жировые дольки. Появляются гистиоциты, поглощающие жир, вышедший из погибших жировых клеток, и остатки самих жировых клеток - так называемые пенистые клетки. В конечной стадия процесс заканчивается нарастанием количества фибробластов и замещением очагов соединительной тканью.
Дифференциальный диагноз. Заболевание следует дифференцировать от постстероидного панникулита, инсулиновой липодистрофии, олеогранулемы, узловатой эритемы, глубокого подкожного саркоида, глубокой формы красной волчанки, липом.
Лечение панникулита спонтанного. При лечении учитывают общее состояние больного, клиническую разновидность спонтанного панникулита и характер течения болезни. Назначают антиоксиданты (альфа-токоферол, липамид, липоевая кислота), общеукрепляющие средства (большие дозы аскорбиновой кислоты, рутин), антибиотики широкого спектра действия, антималярийные препараты. При тяжелом и упорном течении эффективны системные кортикостероиды (преднизолон 50-100 мг), цигостатики (проспидин). Наружно очаги смазывают 5%-ным линиментом дибунола 2-3 раза в сутки, под окклюзионную повязку - один раз в сутки.

[1], [2], [3], [4], [5], [6], [7]
Первичные заболевания билиарной системы недавно были признаны более распространенными, чем считалось ранее. Однако сообщения о них по-прежнему редки.
Заболевания желчного пузыря (калькулезный и некалькулезный холецистит, мукоцеле, желчнокаменная болезнь, неоплазия и др.) достаточно трудно диагностировать у собак и кошек на ранних стадиях, так как симптомы неспецифичны и часто ассоциированы с обструкцией и/или воспалением общего желчного протока, воспалительными заболеваниями печени и др. Поэтому ранее они выявлялись в запущенной форме и подтверждались во время операции и/или аутопсии.
Помимо прогрессирующего ухудшения состояния животного, тяжело протекающий холецистит может приводить к разрыву желчного пузыря и последующему желчному перитониту. Все это требует проведения более тщательной диагностики у пациентов с симптомами, указывающими на холецистит, и индивидуального подхода при выборе лечения.
Холецистит – это воспаление желчного пузыря. Согласно этиологии выделяют три категории повреждений желчного пузыря: обструктивные, необструктивные и разрывы пузыря и/или желчных протоков, а также острую и хроническую формы протекания заболевания.
Обструктивный холецистит развивается чаще всего вследствие сдавления пузырного протока и/или холедоха измененной поджелудочной железой (в этом случае заболевание можно считать вторичным), реже – развития мукоцеле, сгущения желчи, неоплазии кишечника, печени, билиарного тракта, диафрагмальной грыжи и еще реже – образования желчных камней.
Необструктивные формы холецистита чаще всего связаны с наличием инфекционного очага в организме или с паразитарными заболеваниями (печеночная двуустка, лямблиоз и др.). Описанная в гуманной медицине первичная дискинезия желчного пузыря и желчевыводящих протоков как причина развития холецистита в современных ветеринарных источниках литературы не встречается. Возможно, это связано со сложностями в верификации диагноза и выявлением причин и механизма ее развития (у людей – это нарушения гормональной регуляции, стрессы, язвенная и желчнокаменная болезнь, заболевания поджелудочной железы, применение препаратов, вызывающих застой желчи и спазм сфинктера Одди). Дискинезию вторичного генеза так или иначе мы можем предполагать и наблюдать при сонографии желчного пузыря (перерастяжение, образование осадка в полости), при аномалиях развития желчного пузыря (перегибы, стенозы, перетяжки, неполные перегородки в полости пузыря) и после перенесенного ранее холецистита.
Пневмохолецистит (эмфизематозный холецистит) вызывается газообразующими бактериями, такими как E.coli или Clostridium perfringens. Часто наблюдается в сочетании с острым холециститом, сахарным диабетом и на фоне травматической ишемии желчного пузыря.
Разрывы желчного пузыря могут происходить при серьезных травмах (ДТП, падение с высоты, удары) или в результате перфорации измененной стенки желчного пузыря при хронических воспалительных процессах.
Согласно WSAVA Liver Standardization Group среди заболеваний желчного пузыря выделяют нейтрофильный, лимфоплазмацеллюлярный, фолликулярный холециститы, мукоцеле и инфаркты желчного пузыря.
Нейтрофильный холецистит часто наблюдается у кошек и реже у собак и, в общем, ассоциирован с бактериальной инфекцией; может наблюдаться как самостоятельное заболевание или в комбинации с нейтрофильным холангитом. Повреждение характеризуется появлением в полости пузыря, эпителии и стенке желчного пузыря нейтрофилов, при хроническом течении – смешанного воспалительного инфильтрата, содержащего нейтрофилы, лимфоциты, плазматические клетки.
Лимфоплазмацеллюлярный и фолликулярный холецистит возникают в результате формирования лимфоплазмацетарного инфильтрата и/или лимфоидных фолликулов в слизистой желчного пузыря.
Инфаркт желчного пузыря возникает вследствие окклюзии пузырной артерии. Полный или частичный инфаркт желчного пузыря описан у собак. При гистологическом исследовании наблюдают некроз всей толщи стенки желчного пузыря без признаков сопутствующего холецистита и (часто) тромбоз артерий.
Клинические симптомы
В большинстве случаев холецистит наблюдается как острое заболевание. Владельцы отмечают у животного тошноту, рвоту, отказ от корма, боли в области живота. Желтуха является необязательным симптомом, особенно если общий желчный проток свободен, и может проявляться не сразу. Ее появление в этом случае объясняется развитием неспецифического реактивного гепатита и внутрипеченочного холестаза в ответ на эндотоксины из воспаленного желчного пузыря. Холецистит, сопровождающийся застоем желчи, может приводить к ахолии и обесцвечиванию каловых масс. Появление на фоне этих симптомов лихорадки, синдрома острого живота и признаков септического шока (поверхностное дыхание, гипотермия, бледные десна и слабый, но частый пульс) может указывать на разрыв желчного пузыря и требует неотложных мероприятий.
Холецистит может быть хроническим и проявляться периодической тошнотой у животного, признаками дискомфорта после еды, потерей аппетита, снижением веса, диареей или протекать вообще без каких-либо симптомов (а изменения в желчном пузыре будут случайной находкой при ультрасонографии).
Диагностика
Данные анамнеза и физикального осмотра позволяют лишь предположить у животного описываемую патологию, но не дают возможности поставить диагноз. К тому же клиническая картина не отражает в полной мере степень поражения желчного пузыря, а соответственно, не позволяет определить наилучший способ лечения и прогноз заболевания.
На первом этапе диагностики обязательны клинический и биохимический (как можно более полный) анализы крови, факультативным исследованием является моча. Лабораторные тесты позволяют выявить увеличение щелочной фосфатазы, гиперхолестеролемию, гипербилирубинемию без признаков гемолитической анемии. Гипербилирубинемия приводит в конечном счете к билирубинурии. Повышение уровня желчных кислот, глутаматдегидрогеназы и лейкоцитоз очень характерны для данной патологии и дополнительно указывают на необходимость исследования желчи. Повышение трансаминаз будет выявлено только в случае вовлечения паренхимы печени в воспалительный процесс.
При выборе метода диагностики непосредственно холецистита предпочтение отдается визуальным исследованиям и преимущественно ультразвуковой диагностике. Рентгенография оказывается менее чувствительной при данной патологии и информативна только в случае кальцификации стенки желчного пузыря или формирования рентгеноконтрастных камней (Фото 6 и 7).
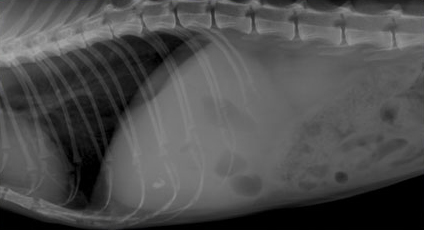
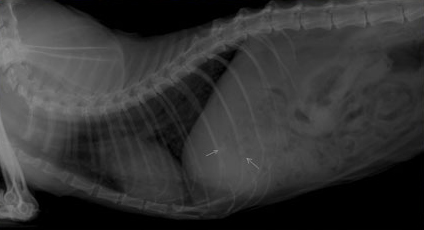
Фото 6 и 7.
В данном разделе мы рассмотрим изменения ультразвуковой картины желчного пузыря и билиарной системы, наблюдаемые при холецистите, не затрагивая возможные изменения поджелудочной железы, неоплазии других органов и т. д.
- Стенка желчного пузыря утолщается (толще 1 мм у кошек и 2-3 мм у собак), становится гиперэхогенной, с неровными краями – признак воспаления, отека (портальная гипертензия, гипоальбуминемия), некроза, гиперплазии слизистой пузыря, реже – неоплазии (Фото 1);
- Наряду с утолщением стенки часто отмечают появление двухконтурного ободка (особенно в более остром периоде) или диффузно гиперэхогенной стенки, иногда сочетающейся с минерализацией (при хронически протекающем процессе) (Фото 2 и 3);
- Утолщение стенки и дилатация просвета общего желчного протока, повышение его извитости. Однако бывает достаточно сложно дифференцировать дилатацию просвета на фоне обструкции от дилатации на фоне холестаза при хроническом воспалительном процессе. Кроме того, при хроническом нарушении оттока общий желчный проток может оставаться дилатированным даже после устранения обструкции (это необходимо учитывать в постоперационном обследовании);
- Появление желчного сладжа. Физиологически желчь может уплотняться и преобразовываться в желчный сладж (желчную грязь). Он представляет собой смесь слизи, билирубината кальция и кристаллов холестерина. В патологических условиях его консистенция и аккумуляция могут осложнить эвакуацию желчи во внепеченочные желчные протоки, что ведет к обструкции последних. Характерный признак желчного сладжа – изменение его вида на сканограмме в зависимости от изменения положения тела животного и медленное достижение нового горизонтального уровня (критерий подвижности сладжа позволяет отличить его от билиарного мукоцеле). Общим правилом является отсутствие дистальной акустической тени. Эхогенность сладжа может быть различной. Иногда сладж заполняет весь желчный пузырь, затрудняя дифференцировку между тканью печени и желчным пузырем. Эта ситуация называется "гепатизация желчного пузыря" (Фото 4 и 5);
- Желчное мукоцеле (муцинозная гиперплазия желчного пузыря) – характеризуется гиперплазией эпителия и сосочковыми разрастаниями, избыточным накоплением слизи, растягивающей желчный пузырь. Заболевание встречается редко, как правило, у собак мелких и средних пород (средний возраст — 9 лет). Является одной из причин развития обструкции внепеченочных желчных протоков и как следствие холецистита. По мере того, как формируется мукоцеле, на сканограмме вначале появляется звездчатый контур, затем поперечный срез желчного пузыря приобретает рисунок киви (фрукта) в поперечном сечении.
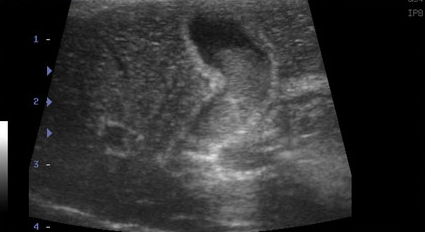
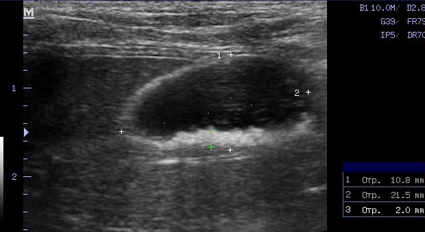
Фото 1 и 2.
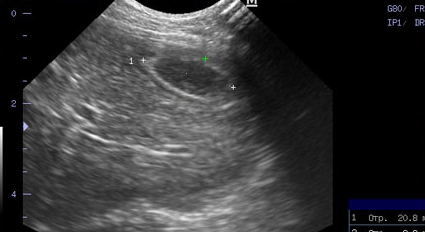
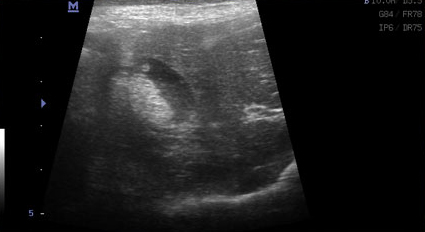
Фото 3 и 4.
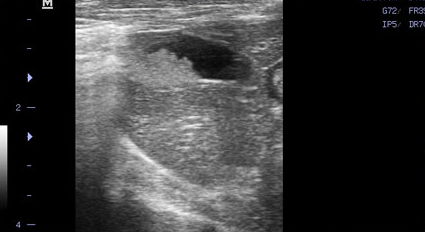
Фото 5.
При любом изменении желчного пузыря или появлении неоднородности желчи на УЗИ необходимо проводить тонкоигольную биопсию с целью аспирации желчи для цитологического и бактериологического исследований. Для этого можно использовать иглы 22-25-го номеров, и при проведении данной процедуры необходимо удалить столько желчи, сколько возможно, для предотвращения просачивания желчи через пункционное отверстие. Вероятность подобного осложнения крайне мала, в своей практике мы такого не встречали, но при наличии недиагностированной вовремя обструкции внепеченочных билиарных трактов риск повышается. Также мы рекомендуем проводить забор материала паренхимы печени для гистологического исследования (процедура забора биоптата для гистологического исследования усложняется ненамного в сравнении с тонкоигольной биопсией печени, но результат во много раз информативнее).
Одним из современных информативных методов является радионуклидное сканирование желчного пузыря (сцинтиграфия), которое позволяет оценить работу желчного пузыря, определить место обструкции протока. К сожалению, в нашей практике этот метод пока недоступен.
При подозрении на желчный перитонит показана диагностическая лапароскопия или лапаротомия.
Лечение
Выбор между терапевтическим и хирургическим методом лечения при данном заболевании осуществляется на основании комплексной оценки состояния животного, наличия сопутствующих заболеваний в анамнезе, наличия заболеваний, спровоцировавших развитие холецистита и, конечно, тяжести и длительности данного заболевания, эффективности предыдущего лечения, если оно проводилось, и появления рецидивов.
Нет смысла проводить консервативное лечение и ждать улучшения картины заболевания у животного в критическом состоянии, идя на поводу у его владельцев, стремящихся сохранить орган. Без воспаленного желчного пузыря животное прекрасно сможет жить. В то же время, если обстоятельства позволяют, можно и нужно проводить интенсивную медикаментозную терапию, во многих ситуациях – успешную.
Итак, если к нам обращается владелец кошки или собаки, у которой наблюдаются вышеперечисленные симптомы и при этом состояние животного удовлетворительное, отсутствует лихорадка, кахексия и безудержная рвота, анализы крови указывают на воспалительный процесс, а УЗИ выявляет необструктивный холецистит, возможно, с незначительным количеством желчного сладжа в полости, то мы осуществляем следующие действия:
- назначаем диету. Удобно для этого использовать промышленные корма при заболеваниях печени, так как в домашних условиях достаточно сложно приготовить механически и химически не раздражающую пищу.
- проводим адекватную антибиотикотерапию (предварительно взяв желчь для бакпосева). В случае, если посев окажется стерильным, – это будет отличной профилактикой вторичной инфекции. Бактериальный, в том числе эмфизематозный, холецистит требует долгосрочного применения антибиотиков:
амоксициллин/ампициллин (10-22 мг/кг каждые 8-12 часов, в/м) или препараты цефалоспоринового ряда (цефоперазон 50 мг/кг каждые 12 часов, в/в или в/м; цефалоспорины 4 -го поколения – цефкином (Кобактан, MSD AnimalHealth)- 0,5 мл/ 5 кг массы один раз в день в/м) и/или метронидазол (15-25 мг/кг каждые 12 часов, в/в) для грамположительной флоры и анаэробов (С.perfringens) на 14-21 день и фторхинолоны для грамотрицательных бактерий (E.coli и др.). Например, энрофлоксацин 5-20 мг/кг в день, п/к, на 10-14 дней.
По результатам антибиотикограммы после посева лечение необходимо корректировать. для улучшения свойств желчи и наилучшего ее отхождения мы назначаем урсодезоксихолевую кислоту (4-15 мг/кг в день, внутрь, лучше всего делить суточную дозу на два приема, в течение нескольких месяцев) и одестон (гимекромон). - при необходимости проводится терапия первичного или сопутствующего заболевания, инфузионная терапия, назначаются спазмолитические средства.
В том случае, если животное находится в критическом состоянии из-за остро развившегося холецистита, или мы имеем дело с рецидивирующим холециститом, или у нас есть все основания предполагать обструктивный холецистит и/или разрыв желчного пузыря и/или холедоха, проводим хирургическое лечение. Выбор метода хирургической коррекции зависит от предполагаемой патологии, возможностей клиники и опыта врача, проводящего манипуляцию. В последнее время холецистэктомия в нашей клинике проводится исключительно лапароскопически, что позволяет снизить травматичность операции, минимизировать осложнения и ускорить восстановительный период. При этом мы обязательно проводим контрастирование желчного пузыря, чтобы убедиться в проходимости желчных путей, и осуществляем промывание холедоха. К сожалению, ввиду анатомических особенностей у кошек и собак на сегодняшний день невозможно использовать эндоскопическую ретроградную холангиопанкреатографию для этих же целей, поэтому используем более инвазивные методы. Конечно, в ситуациях, связанных с разрывом желчного пузыря или обструкцией холедоха, мы прибегаем к классическому способу – лапаротомии. Вариантов операций на желчном пузыре несколько, и выбор хирурга определяется состоянием желчного пузыря, развившейся патологией и т. д. Но для этой темы требуется отдельная статья, поэтому здесь она будет опущена.
Перед проведением операции необходимо убедиться в отсутствии нарушений свертывающей системы крови. Этому могут способствовать длительный застой и нарушение оттока желчи (появляется дефицит витамина К, снижается уровень факторов коагуляции II, VII, IX и X). Поэтому проводят дополнительный анализ крови – коагулограмму. Для предотвращения возможной коагулопатии дополнительно вводят конакион (витамин К1) в дозе 1-2 мг/кг подкожно, этого достаточно для нормализации коагуляции в течение 3-12 часов после введения.
При сопутствующей желтухе у пациентов необходимо помнить об их предрасположенности к гипотонии в послеоперационном периоде и возможном развитии почечной недостаточности.
Ткани удаленного желчного пузыря обязательно отправляются в лабораторию для гистологического исследования.
Следует отметить, что до сих пор о проведении холедохотомии при обструктивных патологиях ведутся споры. Это опять же связано с особенностями анатомии наших пациентов, а точнее с малыми размерами структур билиарного тракта и большим числом описываемых осложнений (негерметичность швов, стенозы в послеоперационном периоде, высокая смертность при проведении подобных операций и др.). Опыт нашей клиники и сообщения S. G. Baker, P. D. Mayhew, S. J. Mehler (Journal of Small Animal Practice, Volume 52, Issue 1, pages 32-37, January 2011) позволяют говорить о низком уровне осложнений при данных операциях и требуют дальнейших разработок.
Прогноз заболевания условно благоприятный, при адекватно проведенном лечении функция желчного пузыря будет полностью сохранена. Наибольшую опасность могут представлять осложнения, связанные с разрывом желчного пузыря и возникновением перитонита. В случае его развития даже при адекватном лечении возможен летальный исход. Также необходимо уделять большое внимание наблюдениям лечащего врача, так как клиническая динамика имеет свои особенности в каждом конкретном случае.
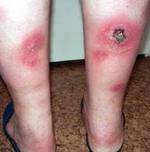
Панникулит — прогрессирующее поражение подкожной жировой клетчатки воспалительного характера, приводящее к разрушению жировых клеток и замещению их соединительной тканью с образованием узлов, бляшек или инфильтратов. При висцеральной форме панникулита происходит поражение жировых клеток печени, поджелудочной железы, почек, жировой клетчатки сальника или забрюшинной области. Диагностика заболевания основана на клинике и данных гистологического исследования. Лечение панникулита зависит от его формы.

- Классификация панникулита
- Симптомы панникулита
- Диагностика панникулита
- Лечение панникулита
- Цены на лечение
Общие сведения
Примерно половина случаев панникулита приходится на спонтанную (идиопатическую) форму заболевания, которая чаще встречается у женщин в возрасте от 20 до 50 лет. Остальные 50% — это случаи вторичного панникулита, развивающегося на фоне системных и кожных заболеваний, иммунологических нарушений, действия различных провоцирующих факторов (холод, некоторые медикаменты). Известно, что в основе развития панникулита лежит нарушение перекисного окисления жиров. Но, несмотря на многочисленные исследования в области этиологии и патогенеза этого заболевания, дерматология до сих пор не имеет четкого представления о механизме его возникновения.

Классификация панникулита
В классификации панникулита выделяют первичную или спонтанную форму заболевания (панникулит Вебера-Крисчена) и вторичную. К вторичному панникулиту относятся:
- иммунологический — нередко наблюдается на фоне системных васкулитов, у детей может быть вариантом течения узловатой эритемы;
- волчаночный (люпус-панникулит) — развивается при глубокой форме системной красной волчанки, характеризуется сочетанием симптомов панникулита с кожными проявлениями, типичными для дискоидной волчанки;
- ферментативный — связан с воздействием панкреатических ферментов, уровень которых в крови повышается при панкреатите;
- пролиферативно-клеточный — возникает при лейкемии, лимфоме, гистиоцитозе и др.
- холодовой — локальная форма панникулита, развивающаяся в ответ на сильное холодовое воздействие, проявляется плотными розовыми узлами, которые проходят в течение 2-3 недель;
- стероидный — может возникать у детей в течение 1-2 недель после окончания общего лечения кортикостероидами, характеризуется самопроизвольным излечением и не требует терапии;
- искусственный — связан с введением некоторых медикаментозных препаратов;
- кристаллический — развивается при подагре и почечной недостаточности в связи с отложением в подкожной клетчатке уратов и кальцификатов, а также при отложении кристаллов после инъекций пентазоцина или менеридина;
- панникулит, связанный с дефицитом α1-антитрипсина (ингибитора α-протеазы), — наследственное заболевание, сопровождающееся системными проявлениями: васкулитами, геморрагиями, панкреатитом, гепатитом, нефритом.
По форме образующихся при панникулите узлов различают узловой, инфильтративный и бляшечный варианты заболевания.
Симптомы панникулита
Основным проявлением спонтанного панникулита являются узловые образования, расположенные в подкожно-жировой клетчатке на различной глубине. Чаще всего они появляются на ногах и руках, реже — в области живота, груди или на лице. После разрешения узлов панникулита остаются очаги атрофии жировой клетчатки, которые выглядят как округлые участки западения кожи.
Узловой вариант панникулита характеризуется появлением в подкожной клетчатке типичных отдельно расположенных узлов размером от 3-4 мм до 5 см. Кожа над узлами может иметь окраску от обычной до ярко-розовой.
Бляшечный вариант панникулита представляет собой отдельные скопления узлов, которые, срастаясь, образуют бугристые конгломераты. Цвет кожи над такими образованиями бывает розовый, бардовый или бардово-синюшний. В некоторых случаях конгломераты узлов распространяются на всю клетчатку голени, плеча или бедра, сдавливая при этом сосудистые и нервные пучки, что обуславливает выраженную болезненность и отек конечности, приводит к лимфостазу.
Инфильтративный вариант панникулита протекает с расплавлением узлов или их конгломератов. При этом в области узла или бляшки, как правило, ярко красного или бардового оттенка, появляется флюктуация, типичная для абсцесса или флегмоны. Однако при вскрытии узлов из них выходит не гной, а маслянистая масса желтого цвета. На месте вскрывшегося узла образуется длительно не заживающее изъязвление.
Смешанный вариант панникулита — встречается редко и представляет собой переход узловой формы в бляшечную, а затем в инфильтративную.
Изменения со стороны подкожной жировой клетчатки в случае спонтанного панникулита могут не сопровождаться нарушением общего состояния пациента. Но чаще в начале заболевания наблюдается симптоматика, схожая с проявлениями острых инфекций (ОРВИ, гриппа, кори, краснухи и др): головная боль, общая слабость, повышение температуры, артралгии, боли в мышцах, тошнота.
Висцеральная форма панникулита характеризуется системным поражением жировых клеток по всему организму с развитием панкреатита, гепатита, нефрита, образованием характерных узлов в забрюшинной клетчатке и сальнике.
По своему течению панникулит может быть острым, подострым и рецидивирующим, длиться от 2-3 недель до нескольких лет. Острая форма панникулита характеризуется выраженным изменением общего состояния с высокой температурой, миалгиями, болями в суставах, нарушением функции почек и печени. Несмотря на проводимое лечение, состояние пациента прогрессивно ухудшается, изредка бывают непродолжительные ремиссии, но в течение года заболевание заканчивается летальным исходом.
Подострое течение панникулита более сглаженное. Для него типично нарушение общего состояния, лихорадка, изменения функциональных проб печени, резистентность к проводимому лечению. Наиболее благоприятно рецидивирующее или хроническое течение панникулита. При этом рецидивы заболевания протекают не тяжело, часто без изменения общего самочувствия и чередуются с длительными ремиссиями.
Диагностика панникулита
Диагностику панникулита дерматолог проводит совместно с ревматологом, нефрологом и гастроэнтерологом. Пациенту назначают биохимический анализ крови и мочи, печеночные пробы, исследование панкреатических ферментов, пробу Реберга. Выявление узлов висцерального панникулита осуществляют с помощью УЗИ органов брюшной полости, УЗИ почек. поджелудочной железы и УЗИ печени. Посев крови на стерильность позволяет исключить септический характер заболевания. Для дифференцировки инфильтративного варианта панникулита от абсцесса проводят бактериологическое исследование отделяемого вскрывшегося узла.
Точный диагноз панникулита устанавливают по результатам биопсии узла. При гистологическом исследовании выявляют воспалительную инфильтрацию, некроз жировых клеток и их замещение соединительной тканью. Диагностика волчаночного панникулита основана на данных иммунологических исследований: определение антинуклеарного фактора, антител к ds-ДНК, комплемента С3 и С4, антител к SS-A и др.
Дифференциальную диагностику панникулита проводят с узловатой эритемой, липомой, олеогранулемой, инсулиновой липодистрофией при сахарном диабете, актиномикозом, индуративным туберкулезом.
Лечение панникулита
Терапия панникулита проводится комплексно в зависимости от его формы и течения. Для лечения узлового панникулита с хроническим течением назначают нестероидные противовоспалительные (напроксен, диклофенак) и антиоксиданты (витамин Е, аскорбиновая кислота), проводят обкалывание единичных узловых образований глюкокортикоидами. Эффективны физиопроцедуры: УВЧ, фонофорез гидрокортизона, магнитотерапия, озокерит, ультразвук, лазеротерапия.
При бляшечной и инфильтративной форме, подостром течении панникулита применяют глюкокортикостероиды (гидрокортизон, преднизолон) и цитостатики (циклофосфан, метотрексат). Для улучшения функции печени целесообразно назначение гепатопротекторов. Лечение вторичных форм панникулита обязательно включает терапию фонового заболевания: панкреатита, СКВ, васкулита, подагры.
Читайте также:

