Можно ли давать собаке пепсан
Опубликовано: 16.05.2024
| Лек. форма | Дозировка | Кол-во, шт | Производитель |
|---|---|---|---|
| капсулы | 4 мг+300 мг | 30 | |
| гель для приема внутрь | 12 14 30 |
Сервисы РЛС ® Аврора Информация о лекарствах для медицинских систем
Содержание
- Действующее вещество
- Аналоги по АТХ
- Фармакологические группы
- Нозологическая классификация (МКБ-10)
- 3D-изображения
- Состав и форма выпуска
- Характеристика
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания препарата Пепсан-Р
- Противопоказания
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Способ применения и дозы
- Передозировка
- Особые указания
- Условия хранения препарата Пепсан-Р
- Срок годности препарата Пепсан-Р
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
Аналоги по АТХ
Фармакологические группы
- Другие желудочно-кишечные средства в комбинациях
- Ветрогонные средства в комбинациях
Нозологическая классификация (МКБ-10)
3D-изображения
Состав и форма выпуска
| Капсулы | 1 капс. |
| диметикон | 300 мг |
| гвайазулен | 4 мг |
| вспомогательные вещества: желатин; глицерол; сорбитол 70% некристаллизуемый; патентованный синий V; титана диоксид; вода очищенная |
в контурной ячейковой упаковке 10 шт.; в пачке картонной 3 упаковки.
| Гель для приема внутрь | 1 саше |
| диметикон | 3 г |
| гвайазулен | 4 мг |
| вспомогательные вещества: сорбитол 70% кристаллизуемый; каррагенаны; натрия цикламат; метилпарагидроксибензоат; масло мяты перечной; вода очищенная |
в саше по 10 г; в пачке картонной 12, 14 или 30 саше.
Описание лекарственной формы
Капсулы: синего цвета, мягкие, продолговатые, блестящие, вместимостью от 270 до 333 мкл; содержимое капсул — вязкий раствор синего цвета.
Гель: голубого цвета, с мятным запахом.
Характеристика
Фармакологическое действие
Фармакодинамика
Оказывает противовоспалительное действие, снижает секрецию соляной кислоты в желудке, уменьшает газообразование в кишечнике.
Гвайазулен обладает выраженным противовоспалительным эффектом, ослабляет аллергические реакции, усиливает регенеративные процессы, оказывает антиоксидантное действие. Благодаря ингибирующему эффекту на освобождение гистамина из мастоцитов, клеток слизистой оболочки желудка, тормозит кислотную секрецию.
Диметикон — гидрофобное полимерное вещество с низким поверхностным натяжением, снижающее газообразование в кишечнике и покрывающее защитной пленкой стенки пищеварительного канала.
Фармакокинетика
Данные о фармакокинетике препарата Пепсан-Р не предоставлены.
Показания препарата Пепсан-Р ®
гастроэзофагеальная рефлюксная болезнь 0–I степени;
повышенная кислотность желудочного сока;
функциональные расстройства ЖКТ , проявляющиеся изжогой, отрыжкой, повышенным газообразованием, тошнотой, запорами и/или диареей;
подготовка к рентгенологическому, ультразвуковому или инструментальному исследованию органов брюшной полости.
Противопоказания
повышенная чувствительность к компонентам препарата;
детский возраст до 14 лет (капсулы);
детский и подростковый возраст до 18 лет (гель для приема внутрь).
Применение при беременности и кормлении грудью
Возможно применение препарата при беременности и в период грудного вскармливания.
Побочные действия
Редко — аллергические реакции, боли, вздутие живота.
Взаимодействие
Лекарственное взаимодействие не установлено.
Способ применения и дозы
Внутрь, перед приемом пищи или при возникновении боли, по 1 капс. или саше 2–3 раза в сутки. Курс лечения определяется индивидуально.
При подготовке к исследованиям органов брюшной полости — по 1 капс. или саше 2–3 раза в сутки накануне исследования и 1 капс. или саше утром в день исследования.
Передозировка
Возможно усиление побочных эффектов.
Особые указания
Гель для приема внутрь не содержит сахара, поэтому не противопоказан пациентам с сахарным диабетом.
Условия хранения препарата Пепсан-Р ®
Хранить в недоступном для детей месте.
Срок годности препарата Пепсан-Р ®
Не применять по истечении срока годности, указанного на упаковке.
Введение
Судорожные припадки обусловлены пароксизмальными синхронными разрядами нейронов, обычно возникающими в коре головного мозга.
Эпилепсия – это общий термин, который относится к повторяющимся судорожным припадкам любого типа, и ее можно разделить на различные этиологические категории:
- Первичная или идиопатическая эпилепсия. Судорожные припадки, которые возникают при отсутствии явного структурного заболевания мозга. Обычно подразумевается наследственная основа, и это подтверждено у многих популярных пород собак, таких как лабрадор-ретриверы, немецкие овчарки, золотистые ретриверы и таксы. Также поражаются многие другие породы.
- Вторичная или симптоматическая эпилепсия. Судорожные припадки возникают из-за специфического поражения головного мозга, такого как опухоль мозга или энцефалит.
- Криптогенная или вероятно симптоматическая эпилепсия. Не выявлено определенной причины судорожных припадков, но предполагается, что припадки являются вторичными (симптоматическими).
- Реактивная эпилепсия. Судорожные припадки возникают из-за экстракраниального заболевания, такого как, например, гипогликемия.
Причины припадков
Идентификация припадков
Диагностика эпилепсии
Наиболее эффективное лечение судорожных припадков возможно только в том случае, когда поставлен диагноз.
Причины возникновения судорожных припадков перечислены в таблице 1. Первичные проявления, анамнез и клинические симптомы позволяют приоритизировать дифференциальные диагнозы и выбрать соответствующие диагностические тесты.4
Если подозревается симптоматическая или реактивная эпилепсия (например, 12-летний золотистый ретривер с припадками, появившимися впервые), рекомендуется полное диагностические обследование, включающее минимальный набор данных, тест на толерантность к желчным кислотам, визуализационные исследования головного мозга и анализ цереброспинальной жидкости. Во многих случаях полное обследование не является необходимым при первом появлении припадков (например, в остальном здоровая 3-летняя немецкая овчарка с недавно появившимися припадками), однако всегда рекомендуются получение минимального набора данных, проведение теста на толерантность к желчным кислотам и офтальмоскопия. Тест на толерантность к желчным кислотам не только исключает портосистемный шунт, но и является исходной мерой функции печени, которую можно использовать впоследствии, если животному будут назначены гепатотоксические препараты, например фенобарбитал.
Всем владельцам животных можно выдать список симптомов, за которыми нужно следить и которые могут свидетельствовать о причинном заболевании головного мозга (изменения в поведении, спотыкание, нарушения зрения) и поэтому требуют более развернутого диагностического обследования.
Судорожные припадки являются наиболее частым и, как правило, единственным симптомом, свидетельствующим о наличии опухоли головного мозга.
Поэтому исключительно важно рекомендовать визуализацию мозга посредством компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) любой собаке старше 6 лет с судорожными припадками, появившимися впервые. Некоторые породы предрасположены к специфическим болезням, следовательно, первичные симптомы также будут определять рекомендации. Например, впервые появившиеся судорожные припадки у 4-летнего боксера с большей вероятностью обусловлены опухолью головного мозга, чем первичной эпилепсией. Сходным образом первое появление припадков у 2-летнего мопса, вероятнее всего, является результатом энцефалита. Кошки более чувствительны к гипертензии и ее последствиям, чем собаки, но у обоих видов животных важно попытаться измерить кровяное давление и исследовать сетчатку на наличие признаков сосудистого или иного заболевания.
Когда лечить судорожные припадки
Большинство судорожных состояний вызывают рецидивирующие припадки, которые по природе являются прогрессирующими из-за постепенного включения дополнительных нейронов в судорожные очаги (киндлинг-эффект). Если первопричина припадков может быть идентифицирована, то лечение должно быть направлено на эту причину. Применение противоэпилептических средств показано, если поставлен диагноз первичной эпилепсии или если лечение первопричины припадков при вторичной эпилепсии не обеспечивает контроль припадков (например, у животных с опухолями головного мозга, гидроцефалией или энцефалитом). До начала лечения важно определить частоту припадков, поскольку противоэпилептические средства имеют побочные эффекты и не всегда являются необходимыми. Например, если лечение припадков начато после первого припадка, то уже никогда не будет ясно, был ли этот припадок единственным, и трудно определить, можно ли прекратить лечение или нет. Исключением из этого правила являются случаи, когда диагноз поставлен и дальнейшие припадки могут угрожать жизни животного. Например, если у животного был один припадок и диагностирована опухоль головного мозга, то последующие припадки могут вызвать фатальное повышение внутричерепного давления, и пациенту следует немедленно назначить противоэпилептические средства.
Общее эмпирическое правило состоит в том, что припадки следует лечить, если они возникают чаще, чем раз в месяц, если они возникают кластерами или сочетаются с эпилептическим статусом, или если они сопровождаются неприемлемыми побочными эффектами (например, исключительно длительным послесудорожным периодом, злобой или обструкцией дыхательных путей у брахицефальных пород собак).
Во всех случаях наиболее эффективное лечение животного требует полного понимания и согласия его хозяина, поэтому до начала лечения важно определить ожидания владельца.
Какой лекарственный препарат использовать у собак
Для лечения судорожных припадков у собак исторически использовали два лекарственных препарата – фенобарбитал и бромид калия. Оба лекарства эффективны как по отдельности, так и в комбинации. Примидон не рекомендован из-за его гепатотоксичности, а диазепам не является эффективным оральным противоэпилептическим средством из-за его короткого периода полувыведения у собак. Период полувыведения фенобарбитала составляет от 48 до 72 часов, и его следует давать перорально два раза в день. Стартовая доза равна 2–4 мг/кг перорально два раза в день, и постоянный уровень препарата в крови достигается за 10–14 дней. Если необходимо быстрое прекращение припадков (например, у собаки болезнь начинается с кластерных припадков), введение дозы, равной 12 мг/кг и распределенной на 24–48 часов, обеспечит терапевтические уровни фенобарбитала в крови, хотя эта доза вызовет временную седацию.
Преимуществами фенобарбитала являются хорошая эффективность, доступность, разумная цена, удобный режим дозирования и быстрота, с которой изменения дозы отражаются в концентрациях в крови, что обеспечивает легкость регулирования дозы.
Недостатками являются необходимость ведения документации (это контролируемый лекарственный препарат), полифагия, полиурия/полидипсия, первоначальная седация (должна пройти примерно через неделю) и седация при необходимости более высоких концентраций препарата в крови, гепатотоксичность (чаще всего связанная с концентрациями в крови, превышающими 35 мкг/мл), нейтропения и тромбоцитопения (очень редкое осложнение), некролитический дерматит и взаимодействие с другими лекарственными препаратами (не следует использовать совместно с циметидином, хлорамфениколом или кетоконазолом). Может развиться толерантность к фенобарбиталу, которая с течением времени потребует более высоких доз для поддержания того же уровня в крови. Терапевтические концентрации в крови лежат в диапазоне 15–45 мкг/мл, хотя концентрации, превышающие 35 мкг/мл, связаны с повышенным риском гепатотоксичности. После достижения стабильного состояния изменения дозы, необходимые для достижения желаемого уровня в крови, можно рассчитать с использованием следующего уравнения: новая доза = текущая доза × желаемый уровень в крови / измеренный уровень в крови. Необходимая доза определяется частотой припадков, концентрацией препарата в крови и тяжестью имеющихся побочных эффектов. Состояние собак, получающих лечение фенобарбиталом, следует контролировать через каждые 6–12 месяцев посредством физикального обследования, измерения концентраций фенобарбитала в крови и биохимического профиля с целью выявления признаков гепатотоксичности. При внезапном резком возрастании концентраций ферментов печени (ожидаемым является их умеренное возрастание при лечении фенобарбиталом) или снижении концентрации альбумина необходимо провести дополнительное исследование в форме теста на толерантность к желчным кислотам.
Следует отметить, что резкое прекращение лечения припадков (фенобарбиталом или бромидом калия) может привести к фатальному эпилептическому статусу или рецидиву припадков, которые гораздо труднее контролировать.
Бромид калия с большим успехом использовали как дополнение к терапии фенобарбиталом у собак с устойчивыми к лечению припадками. В настоящее время его все чаще используют как единственное средство при лечении собак. Бромид калия имеет длительный период полувыведения, колеблющийся в диапазоне от 24 до 46 дней, в зависимости от содержания соли в пищевом рационе и функции почек. Его следует давать один раз в день в дозе, равной 25–40 мг/кг/день, и постоянный уровень в крови достигается через 3–4 месяца. Для более быстрого достижения терапевтических концентраций в крови (100–300 мг/дл) можно нагружать животное этим препаратом в дозе, равной 100–130 мг/кг/день, в течение 5 дней, после чего снизить дозу до поддерживающей, равной 30 мг/кг. Концентрацию в крови следует проверить после 5-дневного применения нагрузочной дозы и через 4–6 недель, чтобы убедиться в том, что терапевтические уровни сохраняются. В экстренных случаях терапевтические уровни могут быть достигнуты за один день посредством орального введения 200 мг/кг с небольшим количеством корма с 2–3-часовыми интервалами (общая доза равна 600 мг/кг).
Преимуществами бромида калия являются хорошая эффективность, особенно при использовании дополнительно к терапии фенобарбиталом, отсутствие гепатотоксичности, дозирование один раз в день, разумная цена и отсутствие статуса контролируемого лекарственного средства.
Недостатками являются полиурия/полидипсия и полифагия, седация и слабость задних конечностей при высоких концентрациях в крови (в частности, в сочетании с фенобарбиталом), отсутствие разрешения на использование в ветеринарии, необходимость постоянного пищевого рациона (изменения содержания соли в пищевом рационе изменяют концентрации препарата в крови), раздражение желудочно-кишечного тракта, состояние кожи, называемое бромодермой, и возможная связь с гиперлипемией и панкреатитом. Бромид калия имеется в продаже в жидкой форме и в форме капсул. Считается, что капсулы с большей частотой вызывают побочные эффекты со стороны желудочно-кишечного тракта, поскольку растворение капсулы обеспечивает фокусирование солевого раствора внутри желудка. Раздражение желудочно-кишечного тракта можно минимизировать посредством дачи лекарства с кормом.
Принимая решение о начале лечения фенобарбиталом, бромидом калия или комбинацией обоих препаратов, следует учесть несколько факторов. Например, если собака очень молодая, то желательно начать лечение бромидом калия, а фенобарбитал добавить только в случае необходимости, чтобы минимизировать время, в течение которого собака получает гепатотоксический препарат. Если заболевание впервые проявилось в форме кластера тяжелых припадков, обычно предпочтительно сразу же начать лечение животного фенобарбиталом, поскольку в этом случае можно быстрее достичь постоянных концентраций в крови, а препарат можно вводить внутривенно. Если владелец животного не может давать препарат через каждые 12 часов, то препаратом выбора может быть бромид калия, поскольку его можно давать через каждые 24 часа. Наконец, следует учитывать побочные эффекты препаратов, и собак с заболеванием печени не следует лечить фенобарбиталом, тогда как использования бромида калия лучше избежать при лечении собак с панкреатитом в анамнезе.
В последнее время в США и Европе более доступными стали препараты Леветирацетам (Кеппра) и Зонисамид (Зонегран), которые можно добавлять к бромиду калия и фенобарбиталу или использовать вместо них.
Зонисамид (Зонегран) – это производное сульфонамида, которое впервые было использовано в Японии в 1989 г. Он лицензирован в Соединенных Штатах Америки с 2000 г., однако дженерики появились только в последнюю пару лет. Механизм действия еще не полностью выяснен, однако, по-видимому, он абсолютно иной, нежели у фенобарбитала и бромида калия. Известно, что он блокирует возбуждающие натриевые и кальциевые каналы, предполагалось, что он является ингибитором карбоангидразы (хотя это не считается важным механизмом регулирования судорожных припадков) и влияет на синтез и распад нейромедиаторов. Он метаболизируется печенью (не через цитохром Р450) и имеет достаточно длительный период полувыведения, равный 18–28 часам, так что его можно давать собакам два раза в день – большое преимущество перед многими другими лекарствами, которые нужно давать чаще.
В исследованиях собак, проведенных в Японии, были определены дозы, необходимые для достижения концентраций в крови, признанных терапевтическими, и было показано, что подходящей стартовой дозой для животных, не получающих фенобарбитал, является доза, равная 5 мг/кг два раза в день, тогда как животным, получающим фенобарбитал, необходима доза, равная 10 мг/кг два раза в день. Дозу можно повышать достаточно безопасно; в исследованиях хронической токсичности для собак дозы до 75 мг/кг/день использовали в течение года с минимальными эффектами на аппетит и массу тела.
Побочные эффекты, отмеченные у собак, которых одновременно лечили дополнительными противоэпилептическими средствами, включали атаксию (реагировавшую на снижение дозы), летаргию и рвоту. Недавно у нас был случай, в котором, по-видимому, развилась идиосинкразическая гепатотоксичность, которая разрешилась после прекращения приема препарата. Опубликованы два исследования клинической эффективности зонисамида как дополнительного средства при лечении стойкой эпилепсии у собак, и в обоих случаях были получены впечатляющие реакции со снижением припадков у 58 % и 82 % собак. Однако эти исследования не были контролируемыми и включали относительно малое количество пациентов. Благодаря безопасности, доступности и практичности дозирования (два раза в день) этот лекарственный препарат в настоящее время является препаратом первого выбора для лечения собак с первичной эпилепсией. Хотя в настоящее время еще нет данных относительно его эффективности при использовании в качестве единственного средства, эти данные, по-видимому, появятся в течение следующих нескольких лет. Базовые концентрации в крови взяты из опубликованных данных, полученных у людей, и определены как 10–40 мкг/мл; концентрации в крови могут быть измерены в лаборатории фармакологии Колледжа ветеринарной медицины Обернского университета, но это довольно дорогостоящая процедура. Однако относительная безопасность данного лекарственного препарата делает мониторинг его концентраций в крови менее критичным, чем при использовании таких препаратов, как фенобарбитал. Мы обычно измеряем концентрацию в крови в том случае, если судорожные припадки плохо контролируются, а доза является высокой: это полезно для того, чтобы определить, поможет ли дальнейшее повышение дозы.
Фармакокинетика и токсичность зонисамида также была исследована на кошках, и, хотя препарат показал себя как безопасный, все же в этом случае нельзя повышать дозы так же, как у собак: примерно у половины кошек, получавших 20 мг/кг/день, развивались летаргия и атаксия, а также симптомы со стороны желудочно-кишечного тракта, такие как анорексия, рвота и диарея. Период полувыведения равен 33 часам, и рекомендована доза, равная 5–10 мг/кг один раз в день.4
Концентрации леветирацетама в плазме могут быть измерены в фармакологической лаборатории в Оберне за ту же цену, что и в случае зонисамида, однако отсутствие побочных эффектов делает эти измерения менее критичными. Кроме того, у людей не было отмечено четкой взаимосвязи между концентрацией в плазме и терапевтическим эффектом. Несмотря на то что препарат обычно применяют в виде дополнительной терапии в устойчивых к лечению случаях, основными препятствиями к его использованию являются неудобство дозирования (три раза в день), а также, как и в случае зонисамида, отсутствие в настоящее время данных о его эффективности в качестве единственного средства.
Леветирацетам использовали для лечения кошек.7 Период его полувыведения равен 3 часам, рекомендованная доза была равна 20 мг/кг три раза в день.
Семь из 10 кошек с устойчивой к лечению эпилепсией ответили на лечение леветирацетамом, и лишь у двух возникли побочные эффекты в виде летаргии и снижения аппетита.
Обеспечение эффективного контроля над желудочной секрецией — одно из главных условий успешной терапии так называемых «кислотозависимых» заболеваний верхних отделов желудочно-кишечного тракта. В клинической и поликлинической практике в настоящее время для
Обеспечение эффективного контроля над желудочной секрецией — одно из главных условий успешной терапии так называемых «кислотозависимых» заболеваний верхних отделов желудочно-кишечного тракта. В клинической и поликлинической практике в настоящее время для ингибирования соляной кислоты париетальными клетками слизистой оболочки желудка чаще всего используются блокаторы Н2-рецепторов гистамина второго (ранитидин) и третьего (фамотидин) поколений, несколько реже — ингибиторы протонного насоса (омепразол, рабепразол), а для нейтрализации уже выделенной в полость желудка соляной кислоты — антацидные препараты. Антацидные препараты иногда применяются в лечении больных, страдающих так называемыми «кислотозависимыми» заболеваниями, в сочетании с Н2-блокаторами рецепторов гистамина; иногда в качестве терапии по «требованию» в сочетании с ингибиторами протонного насоса. Одна или две «разжеванные» антацидные таблетки не оказывают значительного эффекта [10] на фармакокинетику и фармакодинамику фамотидина, применяемого в дозе 20 мг.
Между этими медикаментозными препаратами существуют определенные различия, перечислим основные из них: различные механизмы действия; скорость наступления терапевтического эффекта; продолжительность действия; разная степень эффективности их терапевтического действия в зависимости от времени приема препарата и приема пищи; стоимость медикаментозных препаратов [1]. Вышеперечисленные факторы не всегда учитываются врачами при лечении больных.
В последние годы в литературе все чаще обсуждаются вопросы фармакоэкономической эффективности использования в терапии «кислотозависимых» заболеваний различных медикаментозных препаратов, применяющихся по той или иной схеме [2, 7]. Стоимость обследования и лечения больных особенно важно учитывать в тех случаях, когда больные в силу особенностей заболевания нуждаются в продолжительном лечении [4, 6], например при гастроэзофагеальной рефлюксной болезни (ГЭРБ). Это весьма распространенное заболевание, обследование и лечение таких пациентов требуют значительных расходов.
Как известно, у большей части больных ГЭРБ отсутствуют эндоскопические признаки рефлюкс-эзофагита. Однако по мере прогрессирования ГЭРБ появляются патологические изменения слизистой оболочки пищевода. Симптомы этого заболевания оказывают на качество жизни такое же воздействие, что и симптомы других заболеваний, включая и ишемическую болезнь сердца [5]. Замечено [8] отрицательное воздействие ГЭРБ на качество жизни, особенно на показатели боли, психическое здоровье и социальную функцию. У больных, страдающих ГЭРБ, высок риск появления пищевода Барретта, а затем и аденокарциномы пищевода. Поэтому при первых же клинических симптомах ГЭРБ, особенно при возникновении эндоскопических признаков эзофагита, необходимо уделять достаточное внимание своевременному обследованию и лечению таких больных.
В настоящее время лечение больных ГЭРБ проводится, в частности, препаратом фамотидин (гастросидин) в обычных терапевтических дозировках (по 20 мг или по 40 мг в сутки). Этот препарат обладает рядом достоинств: удобство применения (1-2 раза в сутки), высокая эффективность в терапии «кислотозависимых» заболеваний, в том числе и по сравнению с антацидными препаратами [9], а также большая безопасность по сравнению с циметидином. Однако наблюдения показали [1], что в ряде случаев для повышения эффективности терапии целесообразно увеличение суточной дозы гастросидина, что, по некоторым наблюдениям [1], снижает вероятность появления побочных эффектов по сравнению с использованием в повышенных дозах блокаторов Н2-рецепторов гистамина первого (циметидин) и второго (ранитидин) поколений. Преимущество фамотидина [11] перед циметидином и ранитидином заключается в более продолжительном ингибирующем эффекте на секрецию соляной кислоты обкладочными клетками слизистой оболочки желудка.
Существуют и другие преимущества блокаторов Н2-рецепторов гистамина (ранитидина или фамотидина) перед ингибиторами протонного насоса; в частности, назначение этих препаратов на ночь позволяет эффективно использовать их в лечении больных из-за отсутствия необходимости соблюдать определенную «временную» связь между приемом этих препаратов и пищи. Назначение некоторых ингибиторов протонного насоса на ночь не позволяет использовать их на полную мощность: эффективность ингибиторов протонного насоса снижается, даже если эти препараты приняты больными вечером и за час до приема пищи. Однако суточное мониторирование рН, проведенное у больных, лечившихся омезом (20 мг) или фамотидином (40 мг), свидетельствует [3] о том, что продолжительность действия этих препаратов (соответственно 10,5 ч и 9,4 ч) не перекрывает период ночной секреции, и в утренние часы у значительной части больных вновь наблюдается «закисление» желудка. В связи с этим необходим и утренний прием этих препаратов.
Определенный научно-практический интерес вызывает изучение эффективности и безопасности использования фамотидина и омеза (омепразола) в более высоких дозировках при лечении больных, страдающих «кислотозависимыми» заболеваниями верхних отделов желудочно-кишечного тракта.
Нами изучены результаты клинико-лабораторного и эндоскопического обследования и лечения 30 больных (10 мужчин и 20 женщин), страдающих ГЭРБ в стадии рефлюкс-эзофагита. Возраст больных — от 18 до 65 лет. При поступлении в ЦНИИГ у 30 пациентов выявлены основные клинические симптомы ГЭРБ (изжога, боль за грудиной и/или в эпигастральной области, отрыжка), у 25 больных наблюдались клинические симптомы, в основном ассоциируемые с нарушением моторики верхних отделов желудочно-кишечного тракта (чувство быстрого насыщения, переполнения и растяжения желудка, тяжесть в подложечной области), обычно возникающие во время или после приема пищи. Сочетание тех или иных клинических симптомов, частота и время их возникновения, а также интенсивность и продолжительность у разных больных были различными. Каких-либо существенных отклонений в показателях крови (общий и биохимический анализы), в анализах мочи и кала до начала терапии не отмечено.
При проведении эзофагогастродуоденоскопии (ЭГДС) у 21 больного выявлен рефлюкс-эзофагит (при отсутствии эрозий), в том числе у 4 больных обнаружена рубцово-язвенная деформация луковицы двенадцатиперстной кишки и у одного больного — щелевидная язва луковицы двенадцатиперстной кишки (5 больных страдали язвенной болезнью двенадцатиперстной кишки, сочетающейся с рефлюкс-эзофагитом). Кроме того, у одной больной обнаружена пептическая язва пищевода на фоне рефлюкс-эзофагита и у 8 больных — эрозивный рефлюкс-эзофагит. У всех больных, по данным ЭГДС, обнаружена недостаточность кардии (в сочетании с аксиальной грыжей пищеводного отверстия диафрагмы или без нее).
В лечении таких пациентов использовался гастросидин (фамотидин) в дозировке 40-80 мг в сутки в течение 4 недель (первые 2-2,5 недели лечение проводилось в стационаре ЦНИИГ, в последующие 2 недели пациенты принимали гастросидин в амбулаторно-поликлинических условиях). Терапию гастросидином всегда начинали и продолжали при отсутствии выраженных побочных эффектов, пациентам назначали по 40 мг 2 раза в сутки в течение 4 недель; лишь при появлении диареи и крапивницы дозировку гастросидина уменьшали до 40 мг в сутки.
Исследование было выполнено с учетом критериев включения и исключения больных из исследования согласно правилам клинической практики.
При проведении ЭГДС определяли НР, используя быстрый уреазный тест (один фрагмент антрального отдела желудка в пределах 2-3 см проксимальнее привратника) и гистологическое исследование биопсийного материала (два фрагмента антрального отдела в пределах 2-3 см проксимальнее привратника и один фрагмент тела желудка в пределах 4-5 см проксимальнее угла желудка). При обследовании больных при необходимости проводили УЗИ органов брюшной полости и рентгенологическое исследование желудочно-кишечного тракта. Полученные данные, включая и выявленные побочные эффекты, регистрировали в истории болезни.
В период проведения исследования больные дополнительно не принимали ингибиторы протонного насоса, блокаторы Н2-рецепторов гистамина или другие так называемые «противоульцерогенные» препараты, включая антацидные препараты и средства, содержащие висмут. 25 из 30 пациентов (84%) из-за наличия клинических симптомов, ассоциируемых чаще всего с нарушением моторики верхних отделов пищеварительного тракта, дополнительно получали прокинетики: домперидон (мотилиум) в течение 4 недель или метоклопрамид (церукал) в течение 3-4 недель.
Лечение больных ГЭРБ в стадии рефлюкс-эзофагита всегда начинали с назначения им гастросидина по 40 мг 2 раза в сутки (предполагалось, что в случае появления существенных побочных эффектов доза гастросидина будет уменьшена до 40 мг в сутки). Через 4 недели от начала лечения (с учетом состояния больных) при наличии клинических признаков ГЭРБ и (или) эндоскопических признаков эзофагита терапию продолжали еще в течение 4 недель. Через 4-8 недель по результатам клинико-лабораторного и эндоскопического обследования предполагалось подвести итоги лечения больных ГЭРБ.
При лечении больных гастросидином (фамотидином) учитывались следующие факторы: эффективность гастросидина в подавлении как базальной и ночной, так и стимулированной пищей и пентагастрином секреции соляной кислоты, отсутствие изменений концентрации пролактина в сыворотке крови и антиандрогенных эффектов, отсутствие влияния препарата на метаболизм в печени других лекарственных средств.
По результатам анализа обследования и лечения больных ГЭРБ в стадии рефлюкс-эзофагита в большинстве случаев терапия была признана эффективной. На фоне проводимого лечения у больных ГЭРБ с рефлюкс-эзофагитом (при отсутствии эрозий и пептической язвы пищевода) основные клинические симптомы исчезали в течение 4-12 дней; у пациентов с эрозивным рефлюкс-эзофагитом боль за грудиной постепенно уменьшалась и исчезала на 4-5-й день от начала приема гастросидина; у больной с пептической язвой пищевода на фоне рефлюкс-эзофагита — на 8-й день.
Двое из 30 больных (6,6%) через 2-3 дня от начала лечения отказались от приема гастросидина, с их слов, из-за усиления болей в эпигастральной области и появления тупых болей в левом подреберье, хотя объективно состояние их было вполне удовлетворительным. Эти больные были исключены из исследования.
По данным ЭГДС, через 4 недели лечения у 17 пациентов из 28 (60,7%) исчезли эндоскопические признаки рефлюкс-эзофагита, у 11 — отмечена положительная динамика — уменьшение выраженности эзофагита. Поэтому в дальнейшем этих больных лечили гастросидином в амбулаторно-поликлинических условиях в течение еще 4 недель по 40 мг 2 раза в сутки (7 больных) и по 40 мг 1 раз в сутки (4 больных, у которых ранее была снижена дозировка гастросидина).
Весьма спорным остается вопрос — рассматривать ли рефлюкс-эзофагит, нередко наблюдаемый при язвенной болезни (чаще всего при язвенной болезни двенадцатиперстной кишки), как осложнение этого заболевания или же считать его самостоятельным, сопутствующим язвенной болезни заболеванием? Наш многолетний опыт наблюдений показывает, что, несмотря на некоторую связь ГЭРБ и язвенной болезни (их относительно частое сочетание и даже появление или обострение рефлюкс-эзофагита в результате проведения антихеликобактерной терапии), все же язвенную болезнь и ГЭРБ (в том числе и в стадии рефлюкс-эзофагита) следует считать самостоятельными заболеваниями. Мы неоднократно наблюдали больных с частыми обострениями ГЭРБ в стадии рефлюкс-эзофагита (при наличии у них рубцово-язвенной деформации луковицы двенадцатиперстной кишки). Последнее обострение язвенной болезни (с образованием язвы в луковице двенадцатиперстной кишки) у этих больных отмечалось 6-7 и более лет назад (значительно реже, чем рецидивы ГЭРБ в стадии рефлюкс-эзофагита), однако при очередном обострении язвенной болезни с образованием язвы в луковице двенадцатиперстной кишки всегда при эндоскопическом исследовании выявляли и рефлюкс-эзофагит. Мы уверены, что при наличии современных медикаментозных препаратов лечить неосложненную язвенную болезнь значительно легче, чем ГЭРБ: период терапии при обострении язвенной болезни двенадцатиперстной кишки занимает значительно меньше времени по сравнению с терапией ГЭРБ; да и в период ремиссии этих заболеваний пациенты с язвенной болезнью двенадцатиперстной кишки чувствуют себя более комфортно, в то время как больные ГЭРБ вынуждены для улучшения качества жизни отказываться от приема значительно большего количества продуктов и напитков.
При обследовании (через 8 недель лечения) трое из 11 больных по-прежнему предъявляли жалобы, ассоциированные с нарушением моторики верхних отделов желудочно-кишечного тракта. Трое больных при хорошем самочувствии отказались от проведения контрольной ЭГДС через 8 недель. По данным ЭГДС, у 7 из 8 больных отмечено исчезновение эндоскопических признаков эзофагита (в том числе у одной больной — заживление пептической язвы пищевода).
Определение НР проводилось у всех 30 больных: в 11 случаях выявлена обсемененность НР слизистой оболочки желудка (по данным быстрого уреазного теста и гистологического исследования материалов прицельных гастробиопсий). Антихеликобактерная терапия в период лечения больным ГЭРБ в стадии рефлюкс-эзофагита не проводилась.
При оценке безопасности проведенного лечения каких-либо значимых отклонений в лабораторных показателях крови, мочи и кала отмечено не было. У 4 больных (13,3%), у которых ранее наблюдался «нормальный» (регулярный) стул, на 3-й день лечения гастросидином (в дозе 40 мг 2 раза в сутки) был отмечен, с их слов, «жидкий» стул (кашицеобразный, без патологических примесей), в связи с чем доза гастросидина была уменьшена до 40 мг в сутки. Через 10-12 дней после снижения дозы стул нормализовался без какой-либо дополнительной терапии. Интересно отметить, что еще у 4 больных, которые ранее страдали запорами, на фоне проводимого лечения стул нормализовался на 7-й день. У 3 из 30 больных (10%) на 3-4-й день приема гастросидина появились высыпания на коже туловища и конечностей (крапивница). После уменьшения дозировки гастросидина до 40 мг в сутки и проведения дополнительного лечения диазолином (по 0,1 г 3 раза в день) высыпания на коже исчезли.
Проведенные исследования показали целесообразность и эффективность терапии ГЭРБ в стадии рефлюкс-эзофагита гастросидином по 40 мг 2 раза в сутки, особенно при лечении больных с выраженными болевым синдромом и изжогой. Такое лечение может успешно проводиться в стационарных и амбулаторно-поликлинических условиях. Изучение отдаленных результатов проведенного лечения позволит определить продолжительность периода ремиссии этого заболевания и целесообразность лечения гастросидином в качестве «поддерживающей» терапии или же терапии «по требованию».
По вопросам литературы обращайтесь в редакцию

Фосфплюгель – лекарственное средство, которое обладает антацидным и абсорбирующим эффектом.
Составные компонентв и форма выпуска
Препарат производится в виде геля, который имеет апельсиновый вкус.
Действующим веществом является алюминия фосфата. Вспомогательные ингредиенты: пектин, сорбитол, ароматизатор, очищенная вода.
Фармакодинамика
Лекарство оказывает адсорбирующее, обволакивающее и антацидное воздействие. После его приема снижается активность пепсина. Активное вещество убирает излишнее содержание соляной кислоты. При этом физиологические особенности пищеварения остаются неизменными.
После приема происходит обволакивание слизистой оболочки желудка и кишечника, в результате чего появляется защитный слой, который препятствует негативному воздействию внешних факторов и способствует ее заживлению.
Также медикамент способен подавлять газы, устранять токсичные и вредные микроорганизмы в желудке, стабилизируя пассаж ЖКТ.
Лекарство никак не сказывается на электролитном балансе. О фармакокинетике на сегодняшний день нет никакой проверенной информации.
Для чего предназначен Фосфалюгель
Медикамент прописывают принимать в следующих случаях:
язва двенадцатиперстной кишки;
заболевания толстой кишки;
расстройства желудка и кишечника.
Как нужно принимать Фосфалюгель
Медикамент предназначен для внутреннего приема. Лекарство можно принимать в чистом виде либо же развести в кружке с водой. За день можно принять не больше 6 пакетиков.
Ребенку от 6 лет показано принимать не более 2-х пакетиков 2 раза в сутки.
Как долго нужно принимать Фосфалюгель
Продолжительность лечебного курса не должна превышать 2-х недель.
Когда принимать Фосфалюгель: до или после еды
Если у человека отмечается язвенное заболевание желудка либо двенадцатиперстной кишки, то лекарство принимают спустя 2 часа после еды либо же во время проявления сильных болевых ощущений. Пациенты с диафрагмальной грыжей принимают лекарство после приема пищи либо перед сном. При болезни толстой кишки нужно выпивать лекарство с утра на голодный желудок и перед сном. При гастрите и диспепсии препарат выпивают до приема пищи.
Детям до полугода прописывают ¼ пакетика либо 1 ч. л. Принимать необходимо после кормления (не больше 6 раз в сутки). Ребенку от полугода назначают ½ пакетика 4 раза в день после кормления.
Если между приемами болевые ощущения вновь возвращаются, то можно принять средство еще раз.
Как сказано в инструкции, перед вскрытием пакетика его содержимое нужно хорошо размять, чтобы гель стал однородным.
Противопоказания и негативные проявления
От приема препарата стоит отказаться в случае повышенной восприимчивости к составным компонентам препарата, а также лицам, у которых имеются патологии почек. Других противопоказаний у лекарства нет.
Негативные проявления после приема появляются в редких случаях. У людей пожилого возраста, а также лежачих людей может появиться запор.
Поскольку в составе присутствует много ионов алюминия, то может произойти ухудшение моторики кишечника. В случае передозировки нужно выпить слабительное.
Можно ли принимать Фосфалюгель беременным
Лекарство разрешено принимать женщинам в положении только по назначению врача, соблюдая прописанную дозировку.
Можно ли использовать Фосфалюгель при грудном вскармливании
Препарат разрешено принимать в период грудного вскармливания под наблюдением специалиста.
Как хранить Фосфалюгель
Срок хранения – 36 месяцев с даты производства. Хранить нужно в сухо месте при комнатной температуре.
Что лучше: Фосфалюгель или Маалокс
Маалокс реализовывается в жидкой форме. Препарат способен вымывать кальций и фосфор из организма, поэтому Фосфалюгель лучше принимать женщинам в положении, людям в возрасте и детям. По стоимости Маалокс будет дороже.
Что лучше: Фосфалюгель или Альмагель
Альмагель выпускается в виде суспензии. Эта форма считается более эффективной, так как при заболеваниях желудка предпочтение стоит отдавать лекарствам в жидком виде. Оба препарата имеют идентичные свойства. Для кратковременного лечебного курса стоит выбирать Альмагель, так как для продолжительного лечения эффективнее будет Фосфалюгель.
Можно ли принимать Фосфалюгель с алкоголем
При одновременном приеме лекарства и спиртного будет уменьшаться негативное воздействие алкоголя на слизистую оболочку желудочно-кишечного тракта.
Особые указания
Медикамент стоит принимать с особой осторожностью при таких проблемах и патологиях: цирроз печени, заболевания сердечно-сосудистой системы и почек.
У пациентов в возрасте и людей с болезнями почек может отмечаться увеличение количества алюминия в плазме.
Если после приема лекарства появился запор, то нужно пить как можно больше жидкости.
Так как в составе нет сахара, то препарат разрешается принимать людям с сахарным диабетом.
Использование лекарства никак не отражается на результатах рентгенологических обследований.
Применение Фосфалюгеля не может никак отразиться на способности управлять транспортным средством и другими опасными механизмами.
Сколько стоит Фосфалюгель
Препарат можно приобрести в аптеке. рецепт врача для этого не требуется. Стоимость лекарства – 200-380 рублей (в зависимости от количества пакетиков в упаковке).
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Авторизуйтесьчтобы оставлять комментарии

Возрастные ограничения 18+

Гастроэзофагеальная рефлюксная болезнь (ГЭРБ, рефлюкс-эзофагит) широко распространена в современном мире.
Симптомами ГЭРБ обычно являются:
- Жжение в груди (изжога), обычно после еды, которое может усиливаться ночью.
- Боль в груди
- Затруднение глотания
- Отрыжка пищей или кислой жидкостью
- Ощущение комка в горле
Если у Вас ночной кислотный рефлюкс, Вы также можете испытывать:
- Хронический кашель
- Ларингит
- Охриплость голоса
- Обострение астмы
- Нарушения сна
ПРИЧИНЫ ГЭРБ
Причиной ГЭРБа являются частые эпизоды рефлюкса кислого содержимого желудка в пищевод и/или глотку.
В норме пища поступает в желудок следующим образом: после глотания мышечные волокна в нижней части пищевода (сфинктер) расслабляются и пропускают пищу или жидкость в желудок. Затем сфинктер сжимается - закрывая возможность обратного заброса пищи.
Если сфинктер несостоятелен - возможен заброс (рефлюкс) содержимого желудка в пищевод. Частые эпизоды рефлюкса приводят к раздражению эпителия пищевода содержимым желудка а также развитию воспаления пищевода - эзофагиту. Эзофагит вследствие рефлюкса так и называется: рефлюкс-эзофагит.
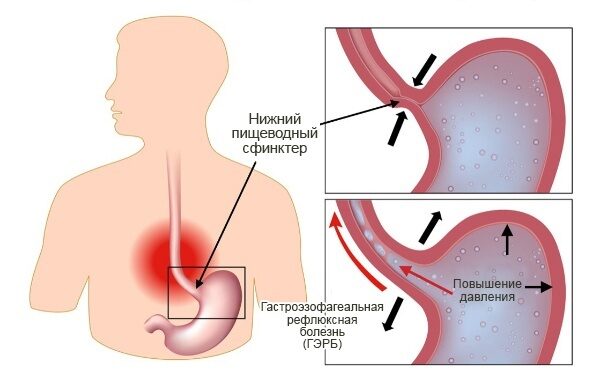
ФАКТОРЫ РИСКА
Ниже перечислены состояния, которые повышают риск развития ГЭРБ:
- О жирение
- Грыжа пищеводного отверстия диафрагмы
- Беременность
- Заболевания соединительной ткани, например склеродермия
- Замедленное опорожнение желудка
- Хронический стресс
Факторы, усиливающие кислотный рефлюкс:
- Курение
- Переедание или прием пищи поздно вечером
- Употребление жареной или жирной пищи
- Употребление газированных напитков, алкоголя или кофе
- Прием некоторых медикаментов, например аспирина

ОСЛОЖНЕНИЯ ГЭРБ
Через некоторое время хроническое воспаление пищевода может привести:
- Сужение пищевода (стриктура пищевода). Повреждение нижнего отдела пищевода кислотой желудка приводит к образованию рубцовой ткани. Рубцовая ткань затрудняет прохождение пищи, что приводит к проблемам с глотанием.
- Открытая рана в пищеводе (язва пищевода). Кислота желудка может уничтожать ткани пищевода, вызывая образование открытой язвы. Язва пищевода может кровоточить, вызывать боль и затруднять глотание.
- Предраковые изменения пищевода (пищевод Барретта). Повреждения от кислоты может вызвать изменения в тканях, выстилающих нижнюю часть пищевода. Эти изменения связаны с повышенным риском рака пищевода.
Традиционное лечение ГЭРБ включает в себя прием ингибиторов протонной помпы, которые снижают секрецию соляной кислоты в желудке. Кроме того, применяются блокаторы Н-2 гистаминовых рецепторов - с этой же целью.
Эти препараты весьма эффективны, но их нужно принимать постоянно, а поскольку имеются побочные эффекты (дефицит витамина В12, нарушение переваривания пищи, тошнота, инфекционные осложнения, деменция и много других), ученые не прекращали поиск альтернативных методов лечения ГЭРБ.
Несколько лет назад появился новый класс средств для лечения рефлюкс-эзофагита: т.н. эзофагопротекторы.
Как и следует из названия, эзофагопротекторы защищают эпителий пищевода от воздействия кислого содержимого желудка. Кроме того, они восстанавливают защитный слой эпителия.
Давайте рассмотрим механизм действия эзофагопротекторов немного подробнее. Начнем со строения и функций эпителия пищевода.
Стенка пищевода состоит из нескольких слоев (изнутри кнаружи):
- Слизистая
- Подслизистый слой
- Циркулярные мышечные волокна
- Продольные мышечные волокна
- Серозная оболочка

В подслизистом слое расположены нервные окончания. Если на них воздействует кислое содержимое желудка, то возникают симптомы рефлюкс-эзофагита (изжога и пр.)
Поскольку рефлюкс содержимого желудка в пищевод встречается и у здоровых людей (только редко), эпителий пищевода обладает защитным слоем, который предохраняет нервные окончания от воздействия соляной кислоты.
Защитный гликозаминогликановый слой пищевода состоит из:
- Гиалуроновой кислоты
- Хондроитинсульфата
- Гепарансульфата
- Дерматансульфата
Защитный слой практически любого эпителия в организме устроен аналогичным образом.

Кроме защитного слоя на поверхности эпителия пищевода, существует т.н. межклеточный матрикс, состоящий также из гиалуроновой кислоты. Клетки находятся на определенном расстоянии друг от друга, но связаны т.н. белками плотных контактов. Тем не менее, между клетками есть промежутки, через которые кислый рефлюктант может достичь нервных окончаний.

В норме межклеточные промежутки заполнены гиалуроновой кислотой, которая защищает нервные волокна от соляной кислоты.
При ГЭРБе защитный слой пищевода несостоятелен. Идея эзофагопротекторов заключается в его замещении и восстановлении.

Подобная идея уже давно применяется в урологии при интерстициальном цистите и называется гликозаминогликан - заместительная терапия. Интерстициальный цистит - заболевание мочевого пузыря вследствие раздражения его нервных окончаний токсичными компонентами мочи. Возникает из-за разрушения защитного слоя эпителия мочевого пузыря.
Для восстановления этого слоя в мочевой пузырь вводят компоненты защитного слоя: гиалуроновую кислоту и/или хондроитинсульфат.
В России зарегистрирован препарат для восстановления гликозаминогликанового слоя: "Протектор эпителия мочевого пузыря "Уролайф"

Из урологии идея перекочевала в онкологию для защиты и восстановления эпителия полости рта после лучевой терапии:


А затем в гастроэнтерологию. В Италии разработали эзофагопротектор "Альфазокс" для защиты и восстановления эпителия пищевода при рефлюксм-эзофагите.
В состав "Альфазокса" входят компоненты защитного слоя эпителия пищевода и межклеточного матрикса: гиалуроновая кислота и хондроитинсульфат. Для продления действия медизделия в рецептуру добавили вязкий термопластичный полимер - т.н. полоксамер.

Клинические исследования продемонстрировали эффективность "Альфазокса", однако для российского потребителя его цена достаточно высока, поэтому врачи и пациенты часто задают вопрос: есть ли российские аналоги "Альфазокса"?
Ответ на этот вопрос не так прост. Если говорить о составе, то средств для лечения ГЭРБ на основе гиалуроновой кислоты, хондроитинсульфата и полоксамера на российском рынке нет. Способ регистрации (медицинское изделие) - тоже пока уникален.
Однако основное значение имеет механизм действия. Ключевым компонентом любого протектора эпителия (в том числе эзофагопротектора "Альфазокса") является гиалуроновая кислота и вот с этой точки зрения - аналоги "Альфазокса" есть.
Российская компания "ЭЗОВИСК" разработала и выпустила композицию для приема внутрь на основе гиалуроновой кислоты и альгината натрия.
Гиалуроновая кислота защищает и восстанавливает эпителий пищевода, однако для этого необходимо "задержать" ее в пищеводе.
Для этого в состав "ЭЗОВИСКа" включили биополимер - альгинат натрия, "связав" его с гиалуроновой кислотой.
За счет разного заряда с эпителием пищевода, альгинат натрия "примагничивается" к нему - продлевая действие композиции.

Кроме того, хорошо известно, что альгинат натрия образует антирефлюксный барьер (т.н. "плот") на поверхности содержимого желудка - предотвращая его заброс в пищевод.

Также в состав "ЭЗОВИСКа" входя антациды для снижения кислотности на поверхности желудочного содержимого и в пищеводе.
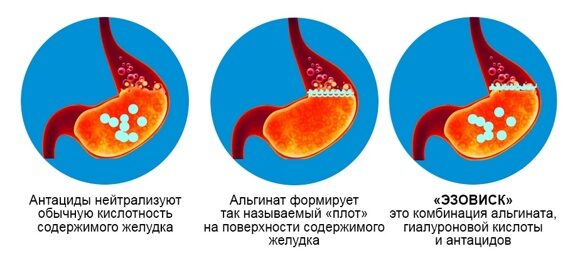
Таким образом, с точки зрения механизма действия композиция на основе гиалуроновой кислоты и альгината натрия обеспечивает эффективную защиту пищевода.
Читайте также:

