Стеаторея лечение у собак
Опубликовано: 09.05.2024
Первичные заболевания билиарной системы недавно были признаны более распространенными, чем считалось ранее. Однако сообщения о них по-прежнему редки.
Заболевания желчного пузыря (калькулезный и некалькулезный холецистит, мукоцеле, желчнокаменная болезнь, неоплазия и др.) достаточно трудно диагностировать у собак и кошек на ранних стадиях, так как симптомы неспецифичны и часто ассоциированы с обструкцией и/или воспалением общего желчного протока, воспалительными заболеваниями печени и др. Поэтому ранее они выявлялись в запущенной форме и подтверждались во время операции и/или аутопсии.
Помимо прогрессирующего ухудшения состояния животного, тяжело протекающий холецистит может приводить к разрыву желчного пузыря и последующему желчному перитониту. Все это требует проведения более тщательной диагностики у пациентов с симптомами, указывающими на холецистит, и индивидуального подхода при выборе лечения.
Холецистит – это воспаление желчного пузыря. Согласно этиологии выделяют три категории повреждений желчного пузыря: обструктивные, необструктивные и разрывы пузыря и/или желчных протоков, а также острую и хроническую формы протекания заболевания.
Обструктивный холецистит развивается чаще всего вследствие сдавления пузырного протока и/или холедоха измененной поджелудочной железой (в этом случае заболевание можно считать вторичным), реже – развития мукоцеле, сгущения желчи, неоплазии кишечника, печени, билиарного тракта, диафрагмальной грыжи и еще реже – образования желчных камней.
Необструктивные формы холецистита чаще всего связаны с наличием инфекционного очага в организме или с паразитарными заболеваниями (печеночная двуустка, лямблиоз и др.). Описанная в гуманной медицине первичная дискинезия желчного пузыря и желчевыводящих протоков как причина развития холецистита в современных ветеринарных источниках литературы не встречается. Возможно, это связано со сложностями в верификации диагноза и выявлением причин и механизма ее развития (у людей – это нарушения гормональной регуляции, стрессы, язвенная и желчнокаменная болезнь, заболевания поджелудочной железы, применение препаратов, вызывающих застой желчи и спазм сфинктера Одди). Дискинезию вторичного генеза так или иначе мы можем предполагать и наблюдать при сонографии желчного пузыря (перерастяжение, образование осадка в полости), при аномалиях развития желчного пузыря (перегибы, стенозы, перетяжки, неполные перегородки в полости пузыря) и после перенесенного ранее холецистита.
Пневмохолецистит (эмфизематозный холецистит) вызывается газообразующими бактериями, такими как E.coli или Clostridium perfringens. Часто наблюдается в сочетании с острым холециститом, сахарным диабетом и на фоне травматической ишемии желчного пузыря.
Разрывы желчного пузыря могут происходить при серьезных травмах (ДТП, падение с высоты, удары) или в результате перфорации измененной стенки желчного пузыря при хронических воспалительных процессах.
Согласно WSAVA Liver Standardization Group среди заболеваний желчного пузыря выделяют нейтрофильный, лимфоплазмацеллюлярный, фолликулярный холециститы, мукоцеле и инфаркты желчного пузыря.
Нейтрофильный холецистит часто наблюдается у кошек и реже у собак и, в общем, ассоциирован с бактериальной инфекцией; может наблюдаться как самостоятельное заболевание или в комбинации с нейтрофильным холангитом. Повреждение характеризуется появлением в полости пузыря, эпителии и стенке желчного пузыря нейтрофилов, при хроническом течении – смешанного воспалительного инфильтрата, содержащего нейтрофилы, лимфоциты, плазматические клетки.
Лимфоплазмацеллюлярный и фолликулярный холецистит возникают в результате формирования лимфоплазмацетарного инфильтрата и/или лимфоидных фолликулов в слизистой желчного пузыря.
Инфаркт желчного пузыря возникает вследствие окклюзии пузырной артерии. Полный или частичный инфаркт желчного пузыря описан у собак. При гистологическом исследовании наблюдают некроз всей толщи стенки желчного пузыря без признаков сопутствующего холецистита и (часто) тромбоз артерий.
Клинические симптомы
В большинстве случаев холецистит наблюдается как острое заболевание. Владельцы отмечают у животного тошноту, рвоту, отказ от корма, боли в области живота. Желтуха является необязательным симптомом, особенно если общий желчный проток свободен, и может проявляться не сразу. Ее появление в этом случае объясняется развитием неспецифического реактивного гепатита и внутрипеченочного холестаза в ответ на эндотоксины из воспаленного желчного пузыря. Холецистит, сопровождающийся застоем желчи, может приводить к ахолии и обесцвечиванию каловых масс. Появление на фоне этих симптомов лихорадки, синдрома острого живота и признаков септического шока (поверхностное дыхание, гипотермия, бледные десна и слабый, но частый пульс) может указывать на разрыв желчного пузыря и требует неотложных мероприятий.
Холецистит может быть хроническим и проявляться периодической тошнотой у животного, признаками дискомфорта после еды, потерей аппетита, снижением веса, диареей или протекать вообще без каких-либо симптомов (а изменения в желчном пузыре будут случайной находкой при ультрасонографии).
Диагностика
Данные анамнеза и физикального осмотра позволяют лишь предположить у животного описываемую патологию, но не дают возможности поставить диагноз. К тому же клиническая картина не отражает в полной мере степень поражения желчного пузыря, а соответственно, не позволяет определить наилучший способ лечения и прогноз заболевания.
На первом этапе диагностики обязательны клинический и биохимический (как можно более полный) анализы крови, факультативным исследованием является моча. Лабораторные тесты позволяют выявить увеличение щелочной фосфатазы, гиперхолестеролемию, гипербилирубинемию без признаков гемолитической анемии. Гипербилирубинемия приводит в конечном счете к билирубинурии. Повышение уровня желчных кислот, глутаматдегидрогеназы и лейкоцитоз очень характерны для данной патологии и дополнительно указывают на необходимость исследования желчи. Повышение трансаминаз будет выявлено только в случае вовлечения паренхимы печени в воспалительный процесс.
При выборе метода диагностики непосредственно холецистита предпочтение отдается визуальным исследованиям и преимущественно ультразвуковой диагностике. Рентгенография оказывается менее чувствительной при данной патологии и информативна только в случае кальцификации стенки желчного пузыря или формирования рентгеноконтрастных камней (Фото 6 и 7).
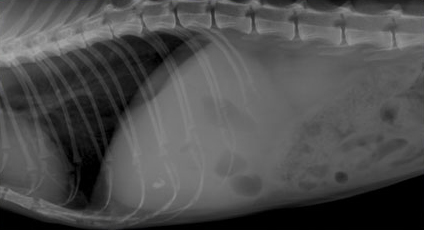
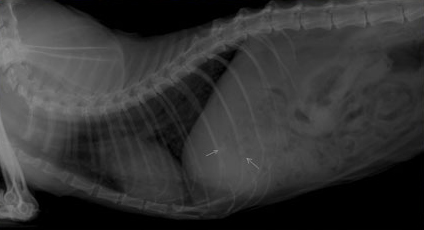
Фото 6 и 7.
В данном разделе мы рассмотрим изменения ультразвуковой картины желчного пузыря и билиарной системы, наблюдаемые при холецистите, не затрагивая возможные изменения поджелудочной железы, неоплазии других органов и т. д.
- Стенка желчного пузыря утолщается (толще 1 мм у кошек и 2-3 мм у собак), становится гиперэхогенной, с неровными краями – признак воспаления, отека (портальная гипертензия, гипоальбуминемия), некроза, гиперплазии слизистой пузыря, реже – неоплазии (Фото 1);
- Наряду с утолщением стенки часто отмечают появление двухконтурного ободка (особенно в более остром периоде) или диффузно гиперэхогенной стенки, иногда сочетающейся с минерализацией (при хронически протекающем процессе) (Фото 2 и 3);
- Утолщение стенки и дилатация просвета общего желчного протока, повышение его извитости. Однако бывает достаточно сложно дифференцировать дилатацию просвета на фоне обструкции от дилатации на фоне холестаза при хроническом воспалительном процессе. Кроме того, при хроническом нарушении оттока общий желчный проток может оставаться дилатированным даже после устранения обструкции (это необходимо учитывать в постоперационном обследовании);
- Появление желчного сладжа. Физиологически желчь может уплотняться и преобразовываться в желчный сладж (желчную грязь). Он представляет собой смесь слизи, билирубината кальция и кристаллов холестерина. В патологических условиях его консистенция и аккумуляция могут осложнить эвакуацию желчи во внепеченочные желчные протоки, что ведет к обструкции последних. Характерный признак желчного сладжа – изменение его вида на сканограмме в зависимости от изменения положения тела животного и медленное достижение нового горизонтального уровня (критерий подвижности сладжа позволяет отличить его от билиарного мукоцеле). Общим правилом является отсутствие дистальной акустической тени. Эхогенность сладжа может быть различной. Иногда сладж заполняет весь желчный пузырь, затрудняя дифференцировку между тканью печени и желчным пузырем. Эта ситуация называется "гепатизация желчного пузыря" (Фото 4 и 5);
- Желчное мукоцеле (муцинозная гиперплазия желчного пузыря) – характеризуется гиперплазией эпителия и сосочковыми разрастаниями, избыточным накоплением слизи, растягивающей желчный пузырь. Заболевание встречается редко, как правило, у собак мелких и средних пород (средний возраст — 9 лет). Является одной из причин развития обструкции внепеченочных желчных протоков и как следствие холецистита. По мере того, как формируется мукоцеле, на сканограмме вначале появляется звездчатый контур, затем поперечный срез желчного пузыря приобретает рисунок киви (фрукта) в поперечном сечении.
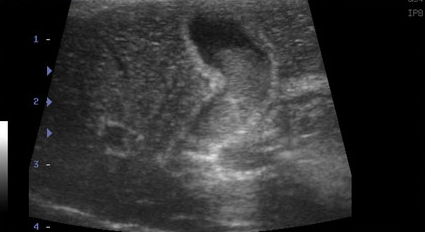
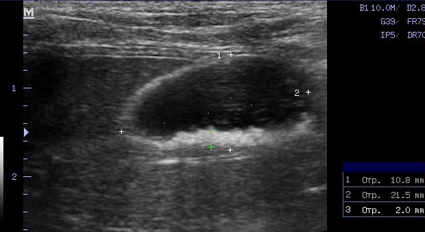
Фото 1 и 2.
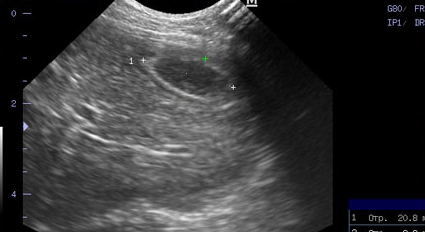
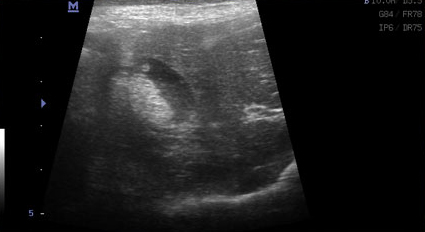
Фото 3 и 4.
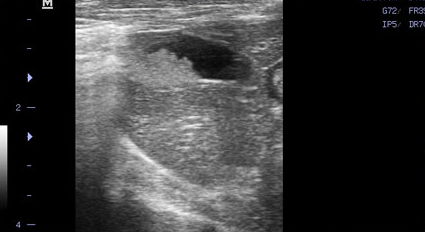
Фото 5.
При любом изменении желчного пузыря или появлении неоднородности желчи на УЗИ необходимо проводить тонкоигольную биопсию с целью аспирации желчи для цитологического и бактериологического исследований. Для этого можно использовать иглы 22-25-го номеров, и при проведении данной процедуры необходимо удалить столько желчи, сколько возможно, для предотвращения просачивания желчи через пункционное отверстие. Вероятность подобного осложнения крайне мала, в своей практике мы такого не встречали, но при наличии недиагностированной вовремя обструкции внепеченочных билиарных трактов риск повышается. Также мы рекомендуем проводить забор материала паренхимы печени для гистологического исследования (процедура забора биоптата для гистологического исследования усложняется ненамного в сравнении с тонкоигольной биопсией печени, но результат во много раз информативнее).
Одним из современных информативных методов является радионуклидное сканирование желчного пузыря (сцинтиграфия), которое позволяет оценить работу желчного пузыря, определить место обструкции протока. К сожалению, в нашей практике этот метод пока недоступен.
При подозрении на желчный перитонит показана диагностическая лапароскопия или лапаротомия.
Лечение
Выбор между терапевтическим и хирургическим методом лечения при данном заболевании осуществляется на основании комплексной оценки состояния животного, наличия сопутствующих заболеваний в анамнезе, наличия заболеваний, спровоцировавших развитие холецистита и, конечно, тяжести и длительности данного заболевания, эффективности предыдущего лечения, если оно проводилось, и появления рецидивов.
Нет смысла проводить консервативное лечение и ждать улучшения картины заболевания у животного в критическом состоянии, идя на поводу у его владельцев, стремящихся сохранить орган. Без воспаленного желчного пузыря животное прекрасно сможет жить. В то же время, если обстоятельства позволяют, можно и нужно проводить интенсивную медикаментозную терапию, во многих ситуациях – успешную.
Итак, если к нам обращается владелец кошки или собаки, у которой наблюдаются вышеперечисленные симптомы и при этом состояние животного удовлетворительное, отсутствует лихорадка, кахексия и безудержная рвота, анализы крови указывают на воспалительный процесс, а УЗИ выявляет необструктивный холецистит, возможно, с незначительным количеством желчного сладжа в полости, то мы осуществляем следующие действия:
- назначаем диету. Удобно для этого использовать промышленные корма при заболеваниях печени, так как в домашних условиях достаточно сложно приготовить механически и химически не раздражающую пищу.
- проводим адекватную антибиотикотерапию (предварительно взяв желчь для бакпосева). В случае, если посев окажется стерильным, – это будет отличной профилактикой вторичной инфекции. Бактериальный, в том числе эмфизематозный, холецистит требует долгосрочного применения антибиотиков:
амоксициллин/ампициллин (10-22 мг/кг каждые 8-12 часов, в/м) или препараты цефалоспоринового ряда (цефоперазон 50 мг/кг каждые 12 часов, в/в или в/м; цефалоспорины 4 -го поколения – цефкином (Кобактан, MSD AnimalHealth)- 0,5 мл/ 5 кг массы один раз в день в/м) и/или метронидазол (15-25 мг/кг каждые 12 часов, в/в) для грамположительной флоры и анаэробов (С.perfringens) на 14-21 день и фторхинолоны для грамотрицательных бактерий (E.coli и др.). Например, энрофлоксацин 5-20 мг/кг в день, п/к, на 10-14 дней.
По результатам антибиотикограммы после посева лечение необходимо корректировать. для улучшения свойств желчи и наилучшего ее отхождения мы назначаем урсодезоксихолевую кислоту (4-15 мг/кг в день, внутрь, лучше всего делить суточную дозу на два приема, в течение нескольких месяцев) и одестон (гимекромон). - при необходимости проводится терапия первичного или сопутствующего заболевания, инфузионная терапия, назначаются спазмолитические средства.
В том случае, если животное находится в критическом состоянии из-за остро развившегося холецистита, или мы имеем дело с рецидивирующим холециститом, или у нас есть все основания предполагать обструктивный холецистит и/или разрыв желчного пузыря и/или холедоха, проводим хирургическое лечение. Выбор метода хирургической коррекции зависит от предполагаемой патологии, возможностей клиники и опыта врача, проводящего манипуляцию. В последнее время холецистэктомия в нашей клинике проводится исключительно лапароскопически, что позволяет снизить травматичность операции, минимизировать осложнения и ускорить восстановительный период. При этом мы обязательно проводим контрастирование желчного пузыря, чтобы убедиться в проходимости желчных путей, и осуществляем промывание холедоха. К сожалению, ввиду анатомических особенностей у кошек и собак на сегодняшний день невозможно использовать эндоскопическую ретроградную холангиопанкреатографию для этих же целей, поэтому используем более инвазивные методы. Конечно, в ситуациях, связанных с разрывом желчного пузыря или обструкцией холедоха, мы прибегаем к классическому способу – лапаротомии. Вариантов операций на желчном пузыре несколько, и выбор хирурга определяется состоянием желчного пузыря, развившейся патологией и т. д. Но для этой темы требуется отдельная статья, поэтому здесь она будет опущена.
Перед проведением операции необходимо убедиться в отсутствии нарушений свертывающей системы крови. Этому могут способствовать длительный застой и нарушение оттока желчи (появляется дефицит витамина К, снижается уровень факторов коагуляции II, VII, IX и X). Поэтому проводят дополнительный анализ крови – коагулограмму. Для предотвращения возможной коагулопатии дополнительно вводят конакион (витамин К1) в дозе 1-2 мг/кг подкожно, этого достаточно для нормализации коагуляции в течение 3-12 часов после введения.
При сопутствующей желтухе у пациентов необходимо помнить об их предрасположенности к гипотонии в послеоперационном периоде и возможном развитии почечной недостаточности.
Ткани удаленного желчного пузыря обязательно отправляются в лабораторию для гистологического исследования.
Следует отметить, что до сих пор о проведении холедохотомии при обструктивных патологиях ведутся споры. Это опять же связано с особенностями анатомии наших пациентов, а точнее с малыми размерами структур билиарного тракта и большим числом описываемых осложнений (негерметичность швов, стенозы в послеоперационном периоде, высокая смертность при проведении подобных операций и др.). Опыт нашей клиники и сообщения S. G. Baker, P. D. Mayhew, S. J. Mehler (Journal of Small Animal Practice, Volume 52, Issue 1, pages 32-37, January 2011) позволяют говорить о низком уровне осложнений при данных операциях и требуют дальнейших разработок.
Прогноз заболевания условно благоприятный, при адекватно проведенном лечении функция желчного пузыря будет полностью сохранена. Наибольшую опасность могут представлять осложнения, связанные с разрывом желчного пузыря и возникновением перитонита. В случае его развития даже при адекватном лечении возможен летальный исход. Также необходимо уделять большое внимание наблюдениям лечащего врача, так как клиническая динамика имеет свои особенности в каждом конкретном случае.

Стеаторея (stear, atos – сало, жир; rhoe – течение) – это повышенное содержание жира и жирных кислот в каловых массах у кошек и собак. В этом случае кал выглядит влажным, маслянистым, имеет серовато-бурый цвет инеприятный, нередко зловонный запах. При этом кал может оставаться оформленным. Частота дефекаций, как правило, возрастает.
В норме панкреатическая липаза в 12-перстной кишке расщепляет жиры корма (триглицериды) на глицерин и высшие жирные кислоты, которые затем расщепляются до более простых составляющих в тонком кишечнике при участии ферментов фосфолипаз.
Стеаторея, причины возникновения:
- Обструкция протока поджелудочной железы (полная или частичная).
- Экзокринная недостаточность поджелудочной железы.
- Хронический панкреатит, панкреонекроз.
- Сахарный диабет.
- Хронический гипосекреторный гастрит.
- Хроническая энтеропатия тонкого кишечника, развитие патогенной микрофлоры.
- Хронический холецистит, холестаз, обструкция желчных протоков в печени.
- Кормление пищей, содержащей большое количество жира.
- Мальабсорбция-нарушение всасывания питательных веществ в кишечнике.
- идиопатическая причина, например, лимфоцитарно-плазмацитарный гастроэнтерит.
- инфекции, инвазии, паразиты (парво- или коронавирусный энтерит, лямблиоз).
- повышенная чувствительность к компонентам корма (пищевая аллергия).
- атрофия кишечных ворсинок (врожденная патология).
- состояние после резекции кишечника (короткий пищеварительный тракт).
- Эндокринное заболевание щитовидной железы-гипертиреоз (чаще у кошек).
Чем опасна стеаторея у собак и кошек?
- В кишечнике нерасщепленный жир обволакивает пищевые массы и затрудняет их переваривание. Неудовлетворительная переваримость корма ведет к потере веса и даже обезвоживанию организма животного.
- Вместе с неусвоенными жирами из кишечника выводятся жирорастворимые витамины (А, D, E, К), что опасно развитием гиповитаминозов.
- Усиление в кишечнике процессов брожения и гниения. Они сопровождаются метеоризмом (повышенным образованием газов в кишечнике).
- Болезненность в эпигастральной области-животное пассивное, большую часть времени оно лежит.
- Возникают частые позывы к дефекации. В эти периоды животное беспокойное, нервозное.
Диагностика
- Подробный анамнез.
- Анализ кала (копрограмма). Кал для исследования должен быть свежим (до 4 часов после акта дефекации) и без примесей (наполнителя или почвы).
- Анализ кала на простейших (лямблиоз), гельминтозы.
- Клинический анализ кровидля определения наличия воспалительного процесса.
- Биохимическийанализ крови для определения концентрации ферментов печени и поджелудочной железы.
- Исследования крови на исключение эндокринных заболеваний (гипертиреоз, сахарный диабет).
- УЗИ внутренних органов (при необходимости).
Стеаторея: лечение собак и кошек
Проводится по следующим направлениям:
- Кормление диетическим кормом с пониженным содержанием жиров.
- Терапия ферментными препаратами при экзокринной недостаточности поджелудочной железы (например, креон).
- Антибиотикотерапия (при выраженной энтеропатии).
- Антипаразитарные, антипротозойные препараты.
- Назначение пребиотиков для повышения всасывания питательных веществ.
- Терапия основного заболевания (сахарный диабет, гипертиреоз).
Профилактика
- Корма премиум-класса, содержащие умеренное количество жира.Следует длительно использовать одну и ту же проверенную марку корма.
- Исключение прикорма натуральными продуктами или другими кормами.
- Своевременная регулярная дегельминтизация животного.
- Профилактическое исследование кала (копрограмма) при изменении его цвета, запаха или консистенции.
© Владимиров Владимир Анатольевич, Ветеринарный врач-терапевт
Московская городская ветеринарная помощь
Вызов врача на дом: (495) 995-06-32, (495) 747-77-05.

Стеаторея — это патологическое состояние, при котором с калом выделяется более 7 г жира в сутки. Проявляется обильным неоформленным стулом с маслянистым блеском, который плохо смывается с унитаза, наличием непереваренных частиц в кале, вздутием и нелокализованной абдоминальной болью. Диагностируется с помощью копрограммы, ретроградной холангиопанкреатографии, УЗИ органов брюшной полости и секретин-панкреозиминового теста. Для лечения применяются стимуляторы панкреатической и желудочной секреции, проводится заместительная терапия компонентами желудочного сока и энзимами поджелудочной железы.
МКБ-10

- Причины
- Патогенез
- Симптомы стеатореи
- Осложнения
- Диагностика
- Лечение стеатореи
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Стеаторея редко является самостоятельной патологией, в большинстве случаев служит симптомом другого расстройства, сопровождающегося нарушением процессов расщепления и усвоения жиров. Наиболее часто признаки стеатореи наблюдаются при нарушениях внешнесекреторной активности поджелудочной железы. Патология одинаково часто выявляется у мужчин и женщин. Обычно развивается после 25-30 лет, хотя врожденные формы могут проявляться в детстве. С учётом состава непереваренных жиров специалисты в сфере практической гастроэнтерологии различают 3 типа расстройства: при 1-м варианте стеатореи в кале преобладает нейтральный жир, при 2-м — жирные кислоты и мыла, при 3-м — присутствуют все указанные компоненты.

Причины
Стеаторея имеет полиэтиологическое происхождение. Первичные (изолированные) формы заболевания наблюдаются при врожденном поражении поджелудочной железы — дисплазии, гипоплазии и аплазии органа, наследственном дефиците панкреатической липазы. Причинами вторичной (симптоматической) стеатореи являются другие патологические состояния:
- Болезни поджелудочной железы. Для гидролиза жиров необходимы панкреатические ферменты липаза и колипаза. Их продукция и секреция нарушается при хроническом панкреатите, объёмных образованиях поджелудочной железы, обструкции панкреатических протоков.
- Заболевания желудка. Недостаточное всасывание жиров в кишечнике отмечается при снижении секреторной функции желудочного эпителия. Признаки стеатореи выявляются при хроническом гастрите с пониженной секрецией, ахилии и болезнях оперированного желудка.
- Гепатобилиарная патология. Для всасывания жира кишечной стенкой требуется достаточное количество желчи. Развитию стеатореи способствуют заболевания с нарушением желчеотделения: холестатические гепатиты, гипомоторная дискинезия желчевыводящих путей.
- Интестинальные расстройства. При хроническом энтерите и избыточном бактериальном росте страдает процесс поступления жировых мицелл в энтероциты. В результате жир, который не прошёл через кишечную стенку, выводится с калом, что проявляется стеатореей.
- Эндокринные болезни. У больных, страдающих сахарным диабетом, причиной стеатореи служит диабетическая энтеропатия и сопутствующая целиакия. Высокое содержание жировых веществ в кале также обнаруживается при полигландулярном синдроме с гипопаратиреозом.
Всасывание жиров ухудшается при паразитарных инвазиях и кишечных инфекциях. Реже возникновение стеатореи связано с разовыми алиментарными нарушениями или пищевыми привычками — употреблением жирных продуктов в количестве, которое превышает возможности производства липолитических веществ. Недостаточное переваривание и абсорбция жира наблюдается при употреблении слабительных и препаратов для лечения ожирения, проведении химиотерапии рака. При отсутствии явных причин для повышенного содержания жиров в кале говорят об идиопатическом варианте заболевания.
Патогенез
Механизм развития стеатореи основан на несоответствии количества употребляемого жира и функциональных возможностей организма по его перевариванию и всасыванию. Ведущим в патогенезе является нарушение различных этапов трансформации липидов в органах ЖКТ. Недостаточное первичное расщепление жира обусловлено снижением желудочной секреции. Незавершенный гидролиз наблюдается при недостатке ключевых липолитических факторов (панкреатических энзимов, желчных кислот), поражении энтероцитов и ускоренном транзите химуса по кишечнику.
Симптомы стеатореи
Патогномоничным признаком заболевания является выделение большого количества неоформленного маслянистого кала, содержащего много нейтрального жира и не смываемого с поверхности унитаза. Стул обычно учащается до 3-6 раз в сутки. Пациенты могут замечать частицы непереваренных продуктов в испражнениях. Полифекалия при стеаторее часто связана с употреблением жареной или жирной пищи. Наблюдаются другие диспепсические проявления: тяжесть и дискомфорт в эпигастральной области, вздутие живота, периодические спазмы в животе.
При осложненном течении заболевания у больных могут развиваться симптомы со стороны других органов и систем. Для стеатореи характерно воспаление и появление эрозий на языке, губах и слизистой оболочке полости рта вследствие дефицита витаминов. У женщин иногда отмечается нерегулярность менструального цикла, олигоменорея. Изменяется общее состояние пациентов, отмечается снижение работоспособности, мышечная слабость, частые головные боли и головокружения.
Осложнения
Наиболее частое последствие заболевания — прогрессирующая потеря массы тела вплоть до кахексии. У пациентов со стеатореей значительно снижается поступление белковых веществ в организм, что провоцирует гипоальбуминемию. Вследствие недостатка белка развиваются гипопротеинемические отеки на лице и конечностях. В тяжелых случаях могут возникать отеки легких или мозга. Нарушение всасывания жирорастворимого витамина Д приводит к остеопорозу, повышенной хрупкости костей.
При стеаторее зачастую обнаруживается энтеропанкреатический синдром, для которого характерна чрезмерная активность бактериальной флоры кишечника. В этом случае у больных наблюдается хронический энтерит или энтероколит, что усугубляет течение болезни. Формируется вторичная недостаточность многих эндокринных желез: гипопитуитаризм, адреналовая недостаточность. Нарушается работа половой системы: у женщин отмечается дисменорея или аменорея, у мужчин — импотенция.
Диагностика
Постановка диагноза при стеаторее осуществляется врачом-гастроэнтерологом, не представляет затруднений, что объясняется характерным видом каловых масс. Диагностический поиск направлен на комплексное лабораторно-инструментальное обследование пациента с целью обнаружения причин патологического состояния. Наиболее информативными являются такие методы исследования, как:
- Микроскопия кала. Для стеатореи патогномонично обнаружение капель нейтральных жиров и жирных кислот при копрологическом исследовании. По количеству и размеру капель жира судят о степени выраженности синдрома: менее 100 включений диаметром до 8 мкм — средняя активность, более 100 крупных капель — тяжелый вариант заболевания.
- Эндоскопическое исследование.Ретроградная холангиопанкреатография позволяет выявить признаки различных заболеваний. В ходе исследования определяются спазм сфинктера Одди, закупорка желчевыводящих путей конкрементами, сужения или воспалительные процессы в панкреатических протоках.
- Сонография. УЗИ брюшной полости применяется для быстрого обнаружения панкреатической и билиарной патологии. На УЗИ при стеаторее может обнаруживаться неоднородность структуры поджелудочной железы с чередованием участков гипер- и гипоэхогенности, утолщение стенок желчного пузыря, желчные камни в протоках.
- Секретин-панкреозиминовый тест. Забор дуоденального содержимого после внутривенной инфузии секретина и панкреозимина используется для оценки показателей внешнесекреторной панкреатической функции. О функциональной недостаточности свидетельствует снижение объема секреции менее 185 мл/ч и уменьшение активности амилазы.
В общем анализе крови может определяться незначительный лейкоцитоз и повышение СОЭ. При длительной стеаторее в биохимическом анализе крови выявляют значительную гипопротеинемию, преимущественно за счет альбуминов, диспротеинемию. Наблюдается снижение уровня основных электролитов крови (натрия, калия, кальция, магния, железа). С целью неинвазивного исследования экзокринной панкреатической секреции применяют дыхательный тест с триглицеридами, мечеными 14С.
При стеаторее необходимо проводить дифференциальную диагностику между двумя основными группами причин этого заболевания: болезнями поджелудочной железы и билиарной системы. На панкреатическую патологию указывает снижение показателей энзимного теста, повышение фекальной эластазы и УЗИ-признаки воспаления органа. Основной критерий диагностики патологии желчевыводящих путей — сонографически или рентгенологически подтвержденные конкременты. Для консультирования пациента может привлекаться гепатолог.
Лечение стеатореи
Выбор методов терапии зависит от причин, вызвавших заболевание. Поскольку у большинства больных патология связана с функциональной несостоятельностью поджелудочной железы или желудка, проводится прямая и косвенная стимуляция их секреции, заместительная терапия. Схема лечения стеатореи может включать следующие группы препаратов:
- Стимуляторы желудочной секреции. Показаны при болезнях желудка с угнетением секреторной функции. Для увеличения продукции пепсина и соляной кислоты обычно используют гистамин и его синтетические аналоги. При неэффективности стимуляторов с заместительной целью назначают средства, содержащие компоненты желудочного сока.
- Панкреатические ферменты. Заместительная энзимотерапия рекомендована при панкреатической стеаторее с высокой суточной потерей жира с калом (от 15 г), нарастающей трофологической недостаточностью, стойкой диареей и диспепсией. Для замещения экзокринной функции поджелудочной железы, улучшения переваривания жира применяют средства, содержащие липазу.
При внепанкреатических формах стеатореи проводится лечение основного заболевания по стандартным терапевтическим протоколам. При этом пациенту могут назначаться антибактериальные и противопаразитарные препараты, антидиарейные средства, пеногасители, прокинетики и миотропные спазмолитики для улучшения желчевыделения, пре- и пробиотики. Для коррекции трофологических расстройств используют витамины К, А, D, E, B12, фолиевую кислоту, витаминно-минеральные комплексы и аминокислотные смеси.
Вне зависимости от этиологии стеатореи пациентам необходима коррекция диеты: частое дробное питание, исключение переедания (особенно во второй половине дня), ограничение суточного количества потребляемого жира до 40-60 г, в первую очередь за счёт животных и термических обработанных жиров. Рекомендован полный отказ от курения и употребления спиртных напитков.
Прогноз и профилактика
Исход зависит от основной причины заболевания и своевременности начатого лечения. При стеаторее вследствие тяжелого поражения панкреатической железы прогноз относительно неблагоприятный, поскольку пациенты нуждаются в проведении пожизненной заместительной терапии. Меры специфической профилактики болезни не разработаны. Для предупреждения синдрома необходимо комплексное лечение патологий, приводящих к нарушению переваривания и всасывания в кишечнике.
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Чаще всего ПС является не самостоятельной патологией, а следствием (осложнением) другого заболевания.
Примечания
1. Если ПС является следствием другого заболевания, при кодировке используется код уточненного основного заболевания.
2. Из данной подрубрики исключены нарушения, являющиеся следствием хирургического вмешательства на желудочно-кишечном тракте (K91.2).

Автоматизация клиники: быстро и недорого!
- Подключено 290 клиник из 4 стран
- 1 место - 800 руб / 4500 тг в мес.
- Регистратура + Касса - 15 800 руб / 79 000 тг в год

Автоматизация клиники быстро и недорого!
- С нами работают 290 клиник из 4 стран
- Подключение 1 рабочего места - 800 руб / 4500 тг в месяц
- Узнать больше о системе
Мне интересно! Свяжитесь со мной
Классификация
По этиологии:
1. Первичная:
- идиопатическая панкреатическая стеаторея;
- стеаторея при генетически обусловленном изолированном дефиците продукции панкреатической липазы;
- при врожденной гипоплазии, дисплазии или аплазии поджелудочной железы (ПЖ).
2. Вторичная:
2.1 При заболеваниях ПЖ:
- хронический панкреатит;
- состояния после резекции ПЖ;
- большие кисты, опухоли ПЖ, приводящие к уменьшению объема функционально активной паренхимы;
- обструкция панкреатических протоков вследствие различных причин;
- сахарный диабет;
- синдром Золлингера-Эллисона;
- муковисцидоз.
2.2 При заболеваниях других органов пищеварения:
- желудка: хронический гастрит с пониженной желудочной секрецией или ахилией, состояния после резекции желудка, демпинг-синдром;
- тонкой и толстой кишок: хронический энтерит, избыточный бактериальный рост;
- печени и желчных путей: холестатические заболевания печени, состояния после холецистэктомии, хронический холецистит с гипомоторной дисфункцией желчного пузыря.
Более редко панкреатическая стеаторея является проявлением состояния после облучения, абдоминального ишемического синдрома, переедания (употребления в пищу количества жиров, превышающего возможности продукции липолитических ферментов).
Этиология и патогенез
Эпидемиология
Факторы и группы риска
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Наиболее типичное проявление ПС - плохая переносимость жирной пищи (особенно жареной и копченой), после потребления которой у больных появляются чувство тяжести в животе и обильный кашицеобразный "жирный" стул. Частота испражнений обычно не превышает 3-6 раз в сутки.
Простой критерий определения "жирности" кала - его способность оставлять жирные, плохо смывающиеся водой следы на унитазе.
Возможно возникновение вздутия живота и коликообразной боли в нем.
При ограничении в рационе жирной пищи и приеме пищеварительных ферментов выраженность проявлений снижается, в некоторых случаях - вплоть до их полного исчезновения.
Начальные проявления ПС:
- потеря массы тела;
- полифекалия;
- "жирный стул";
- лиентерея (макроскопические остатки непереваренной пищи в кале);
- метеоризм;
- спастические боли в животе.
Возможные проявления ПС:
9. При ПС, как правило, нарушается состав кишечной флоры. У больных возникает энтеропанкреатический синдром (избыточный бактериальный рост, энтерит) и существует риск транслокации кишечной флоры из просвета кишечника в брюшную полость, что вызывает развитие бактериальных осложнений.
Диагностика
Обязательное исследование: УЗИ поджелудочной железы (ПЖ), желчного пузыря, печени для выявления заболеваний, приведших к развитию панкреатической стеатореи.
При наличии показаний:
1. Для определения внешнесекреторной функции ПЖ:
- 13С-триглицеридный, 13С-амилазный дыхательные тесты;
- секретин-панкреозиминовый тест (или эуфиллин-кальциевый тест, или тест Лунда).
2. Электрокардиография – проводится для исключения патологии сердечно-сосудистой системы.
5. Компьютерная томография органов брюшной полости и забрюшинного пространства – позволяет выявлять зону некроза при помощи контрастирования.
Лабораторная диагностика
Для диагностики панкреатической стеатореи (ПС) необходимо осуществлять определение экскреции жира с калом. Для диагностики скрытых форм патологии всасывания определение жиров в кале рекомендуется проводить после жировых нагрузок.
Классификация панкреатических функциональных тестов
1. Зондовые - определение содержания бикарбонатов, ферментов в дуоденальном содержимом:
1.1 Прямые (секретин-панкреозиминовый, секретин-церулеиновый, эуфиллино-кальциевый тесты) - стимуляция непосредственно ацинарных и протоковых клеток поджелудочной железы (ПЖ).
1.2 Непрямые (тест Лунда, солянокисло-масляный тест) - стимуляция выработки секретина и панкреозимина.
2. Беззондовые тесты:
2.1 Прямые (эластаза-1, химотрипсин и прочие) - определение содержания панкреатических ферментов в кале.
2.2 Непрямые - определение содержания продуктов гидролиза субстратов:
- в кале (копроскопия, суточное выделение жира);
- в моче (ПАБК-тест, панкреолауриловый тест, тест Шиллинга);
- в выдыхаемом воздухе (триглицеридный, протеиновый, амилазный и прочие).
Зондовые тесты
Секретин-панкреозиминовый тест
Наиболее надежный тест определения внешнесекреторной недостаточности ПЖ. Для проведения данного теста после забора базальной секреции в/в медленно (в течение 3-4 минут) вводят секретин в дозе 1 ЕД/кг массы тела. Непосредственно перед применением во флакон с секретином вводят 10 мл стерильного изотонического раствора натрия хлорида. В 1 мл полученного раствора должно содержаться 10 ЕД секретина. На каждые 10 кг массы тела вводят 1 мл разведенного секретина. После его введения дуоденальное содержимое собирают в три 20-минутные порции.
Далее аналогичным образом панкреозимин в дозе 1 ЕД/кг массы тела (разводят так же, как секретин). После введения панкреозимина дуоденальное содержимое собирают в три 20-минутные порции.
Нормальные показатели секретин-панкреозиминового теста:
- объем секреции - 184 мл/ч;
- концентрация бикарбонатов - 85 ммоль/л;
- активность амилазы - 111 нкат/кг;
- активность липазы - 61 нкат/кг;
- активность трипсина - 4,9 нкат/кг.
Беззондовые тесты
Метод определения фекальной эластазы-1 - чувствительный, неинвазивный тест для диагностики хронического панкреатита. Данный тест превосходит по чувствительности фекальный химотрипсин при диагностике хронического панкреатита, однако не достоверен при слабом или умеренном течении заболевания.
Метод диагностики хронического панкреатита по фекальной эластазе-1 положительно коррелирует с определением инвазивным методом в дуоденальном содержимом основных панкреатических ферментов: амилазы, липазы, трипсина и химотрипсина.
Метод Ван де Камера - точный и сравнительно простой метод количественного определения жиров в кале. Рекомендуется проводить тест при нахождении больных на стандартной диете, содержащей 50-100 г жира.
Общий жир, жирные кислоты и нейтральный жир, определяемые вначале на 100 г кала обязательно пересчитывают на суточное количество кала. Все данные, полученные этим методом, должны исходить из суточного выделения жиров с калом.
Стул собирается в течение 3-х суток (при запорах - 5-и суток), осуществляется последовательное исследование кала из каждой суточной порции, затем выводятся средние показатели за 3 дня.
У здоровых лиц, принимающих жир в физиологических пределах, суточное выделение жира с калом не превышает 5 г. Умеренная стеаторея регистрируется при выделении 5-10 г жиров с калом, выраженная стеаторея - свыше 10 г.
Трансформированная инфракрасная спектрометрия Фурье - метод измерения липидов в фекалиях (предложен Sallerin и Schroeder).
РАВА- или ПАБК-тест, а также пептидный или бентираминовый тест: вводят внутрь трипептид парааминобензойной кислоты в количестве 1,0-2,0 г (в зависимости от возраста и массы тела); 1 г вещества содержит 340 мг парааминобензойной кислоты. Вещество расщепляется в тонкой кишке при помощи хемотрипсина. Процент отщепления парааминобензойной кислоты улавливают по выделению этого соединения с мочой.
Исследование мочи осуществляется в течение 8 часов, в норме за это время выделяется не менее 50% принятой парааминобензойной кислоты.
Проведение фекального теста осложняется тем, что требуется сбор всех испражнений в течение нескольких суток и существует риск смешивания кала с мочой. Диагностические возможности радиоизотопного метода повышаются при параллельном использовании кровяного и фекального тестов. Исследование активности мочи менее надежный метод, чем исследование крови.
С помощью радиоизотопного метода облегчается топическая диагностика абсорбционных расстройств.
Методы, основанные на исследовании крови (метод "спровоцированной гиперлипидемии", хроматографический метод исследования различных фракций липидов, проспароловый тест, вариант теста с липиодолом, вариант ПАБК-теста) относительно ненадежны. Наиболее достоверным и простым методом является определение жировой экскреции с калом. Это связано с тем, что 95% жира всасывается и небольшое снижение этого процента гораздо более заметно при определении выделяемого количества, чем при измерении его абсорбции.
В диагностике ПС применяется также такой простой метод, как йодолиполовый тест. Йодолипол, принятый внутрь, расщепляется в кишках липазой и выделяется с мочой. По времени экскреции и концентрации йода в моче можно судить об активности липазы.
При наличии показаний:
- железо, кальций, магний, калий, натрий в крови: снижение уровня;
- витамины А, D, E, K в крови: дефицит;
- ПАБК-тест, панкреолауриловый тест или другие тесты, выявляющие внешнесекреторную недостатточность ПЖ;
- бактериологическое исследование кала: нарушенный состав кишечной флоры, энтеропанкреатический синдром (избыточный бактериальный рост, энтерит).
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
- Биология возбудителя
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Основным источником инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена инвазионными яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Наибольший риск заражения у детей, страдающих геофагией. Взрослые заражаются при бытовом контакте с инвазированными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса паратенических хозяев. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка. Не исключается возможность трансплацентарной и трансмаммарной передачи инвазии и у человека.
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
- Клиническая картина токсокароза
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
- Диагностика
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
- Лечение токсокароза
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
- Профилактика
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Читайте также:

