Уреаплазмоз у собаки симптомы и лечение
Опубликовано: 29.04.2024

К сожалению собаки, страдают бактериальными инфекциями, как и люди. Однако не стоит подразумевать под такими инфекциями только бронхиты и пневмонии, очень часто бактериальной инфекцией поражается и мочеполовая система собаки. Таким бактериальным заболеванием является уреаплазмоз, который вызывается бактериями семейства Mycoplasmatacea.
Путями передачи уреаплазмоза являются:
- Половой контакт с инфицированной собакой.
- Родовая деятельность, от матери к щенкам.
- Пользование одними гигиеническими приспособлениями с инфицированным псом.
Возбудители, находятся в теле 80% животных, и не приносят дискомфорта, симптомы заболевания проявляются, только в том случае, если превышен определенный уровень концентрации бактерий в организме.
Последствиями этого заболевания могут быть:
- У самок: сальпингит, вагинит, самопроизвольные аборты, рождение нежизнеспособных щенков.
- У самцов: баланопостит, орхит, простатит, аспермия, гипоспермия,
- Общими для обоих полов собак являются такие проблемы с мочеполовой системой как: пиелонефрит, гломерунефрит, мочекаменная болезнь.
- Бесплодие.
Признаки и симптомы заболевания
Инкубационный период уреаплазмоза варьируется в пределах от 3 до 40 дней. Однако у владельцев не возникают подозрение о наличие такого заболевания у своего питомца, так как обращаются к ветеринару с совершенно разнообразной симптоматикой. Микроскопические бактерии могут поражать глаза животного, репродуктивные органы, дыхательную систему желудочно-кишечный тракт и даже провоцировать артрит. Кроме того часть жизненного цикла уреаплазм проходит в эритроцитах, что приводит к их разрушению, на фоне этого процесса у животного развивается желтуха и тяжелая анемия.

Особенностью этой бактериальной инфекцией является особое строение бактериальной клетки – она не имеет стенки, а то в свою очередь не даёт возможности организму животного сформировать к ней стойкий иммунитет.

Симптоматика проявления уреаплозмоза у каждого животного индивидуальна и зависит от иммунитета животного и «локализации» инфекции. Основными признаками являются:
- Апатия.
- Отсутствие аппетита.
- Побледнение слизистых оболочек.
- Незначительное повышение температуры тела.
- Судороги.
- Рвота, диарея.
Диагностика и лечение
Так как отсутствие каких-либо симптомов при уреаплазмозе довольно распространённое явление, а симптомы если и возникают, то они применимы ко многим бактериальным и инфекционным заболеваниям, то диагностировать уреаплазмоз по одной клинической картине невозможно. Поздняя диагностика заболевания приводит к быстрой адаптации бактерий в организме носителя и как следствие заболевание будет плохо поддаваться стандартному лечению и уреаплазмоз может перейти в хроническую форму.
Для постановки правильного диагноза необходимо проведения клинических анализов крови, мочи и кала, проводить анализы мазков нецелесообразно, так как мелких уреаплазм увидеть в мазке крайне сложно. Так же сложность диагностирования заключается в постоянном колебании количества зараженных клеток у животного. Самым надежным методом диагностики является высев патологического материала на питательной среде.
Уреаплазмоз отличается от других бактериальных инфекций большой стойкостью ко многим известным антибиотикам. Поэтому очень важно лечить питомца тем препаратом, который назначил ветеринар.

Для лечения уреаплазмоза используются антибиотики макролиды и хинолоны, иногда используются антибиотики тетрациклинового ряда, однако довольно часто они могут не давать предполагаемого эффекта, так же лучше не использовать сульфаниламиды, из-за их низкой эффективности. Параллельно с этим применяются препараты для стимуляции иммунитета и физиотерапия. Иногда животным назначаются гомеопатические препараты, однако эффективность лечения ими не доказана.
Во время лечения вторичных заболеваний лучше не использовать нестероидные противовоспалительные препараты, так как они способствуют увеличению площади бактериального поражения в организме пса.
Профилактика
К сожалению вакцины, от уреаплазмоза не существует, а так как инкубационный период длится больше месяца то и зачастую источник заражения найти почти невозможно. Для предотвращения возможного инфицирования необходимо выполнять следующие рекомендации:
- Раз в полгода производить собаке полное профилактическое обследование.
- Не допускать случайных половых контактов во время прогулок.
- Перед вязкой тщательно проверять предполагаемого партнера, требовать справку о состоянии здоровья животного.
- Укреплять иммунитет пса, при необходимости давать животному препараты, которые повышают сопротивляемость организма к инфекциям.
- Не допускать использование совместных гигиенических приспособлений одновременно для нескольких животных.
Существует мнение, что уреаплазмоз может передаваться от собаки к человеку, поэтому очень важно соблюдать меры личной гигиены во время ухода за больным питомцем, к детям и беременным женщинам инфицированных собак подпускать нельзя вовсе.
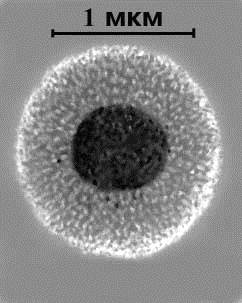
Микоплазмы - мельчайшие свободно живущие микроорганизмы (прокариоты), относятся к семейству Мусоplasmataceae, входящему в порядок Mycoplasmatales класса Mollicutes. Микоплазмы чрезвычайно полиморфные микроорганизмы. В мазках, приготовленных из органов и культур, обнаруживаются округлые, кольцевидные, овальные, кокковидные и нитевидные образования. Клетки имеют различную величину, которая по данным различных авторов, колеблется от 125 до 600 нм. Уникальными для прокариот особенностями микоплазм являются: отсутствие клеточной стенки и ее предшественников ( что в биофизическом плане сближает их с L-формами бактерий), Вместо клеточной стенки они имеют трехслойную мембрану, цитоплазму с ядерной субстанцией, гранулами и вакуолями. Мембрана состоит из полярных липидов и протеинов. Средние размеры клеток микоплазм составляют 0.3—0.8 мкм, а средний диаметр 0.42 мкм. Однако встречаются виды, формирующие на определенных этапах развития протяженные нитевидные клетки, длиной до 150 мкм. Микоплазмы имеют минимальное количество органелл; наименьший среди прокариот размер генома (500-1000 МДа), низкое (23-40%) содержание Г+Ц в ДНК. Обычно колонии миколазм паразитируют на клеточных мембранах эукариот, используя содержимое клеток в качестве пищи. Основным компонентом паразитических видов является свободный и этерифицированный холестерин, обеспечивающий энергию и структурную организацию клетки.
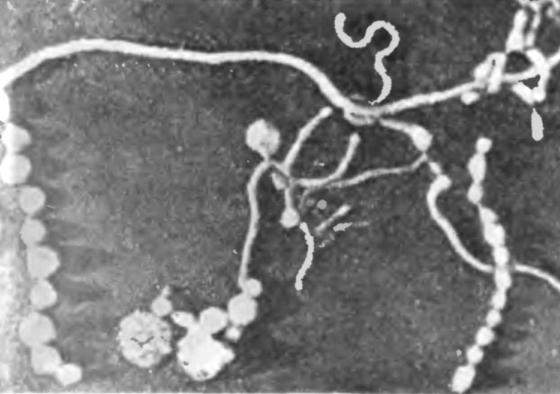
Химический состав клетки состоит из белка в количестве 59,80%, общего азота — 11,20%, нуклеиновых кислот — 6,63%, липидов — 5,10%, и жирных кислот — 2,35%. Количество белка в сухой массе микоплазм колеблется от 54 до 62 мг, в его состав входит до 17 аминокислот. Кроме этого, белковый компонент включает различные ферменты, играющие основную роль в метаболизме микробной клетки.
Геном клетки микоплазм состоит из циркулярной двух спиральной ДНК. При этом репликация генома происходит, как правило, в одной точке роста. Полагают, что форма клетки зависит от цикла развития микроорганизма.
Микоплазмы, в силу своих структурных особенностей, слабо адаптируются на питательных средах. Одни штаммы вызывают помутнение среды, другие образуют легкую пленку. Одни штаммы растут в верхнем слое питательной среды, другие — в придонной части. На полужидких средах с ростовыми добавками микоплазмы растут по уколу или образуют взвешенные крошковатые колонии.
На плотных питательных средах микоплазмы формируют характерные колонии, напоминающие яичницу-глазунью. При этом в первичных посевах рост начинается на 3 и 7 сутки, адаптированные же штаммы растут значительно быстрее. В случае длительного культивирования микоплазмы в глубине агаровой среды образуют полосы преципитации, являющиеся следствием ферментной активности. Колонии прорастают глубоко, размер колоний не превышает 2 мм. Колонии микоплазм, изолированные из патологического материала и принадлежащие разным видам, морфологически сходны. Подмечено, что увеличение периода инкубации повышает частоту выделения патогена. Поэтому посевы на питательных средах рекомендуется выдерживать до 10 дней.
Рост микоплазм определяется присутствием различных питательных веществ. Из белковых веществ для их роста нужен альбумин, стерины, углеводы и витамины. Подмечена также потребность микоплазм в фосфолипидах, солях желчных и жирных кислот. Микоплазмы размножаются равновеликим и неравновеликим делением материнской клетки, почкованием, фрагментацией, а также путем образования в цитоплазме или на ограничивающей мембране клетки «элементарных тел», размером 0.100—0.250 мкм.
В процессе изучения метаболизма установлена биохимическая активность микоплазм. На основе этого признака микоплазм разделяют на ферментативно активные и ферментативно неактивные.
Микоплазмы очень широко распространены в природе. Большинство из них являются паразитами растений и животных, однако некоторые виды являются сапрофитами. Всего насчитывается свыше ста видов микоплазм и свыше двухсот их подвидов (сероваров).
Человек является естественным резервуаром для, минимум, 17 видов микоплазм. Как уже отмечалось, большинство микоплазм, подобно хламидиям, риккетсиям, бартонеллам и вирусам, являются клеточными паразитами. Но, в отличие от упомянутых микроорганизмов, предпочитают населять не ядро или цитоплазму, а клеточные мембраны, располагаясь на их поверхностях, углубляясь в них, или даже «сливаясь» с ними. В человеческом организме объектами паразитирования для микоплазм являются клетки эпителия, нервных волокон, паренхиматозных органов, мышц, суставов, желёз, а также клетки крови и других микроорганизмов, нормально или патологически населяющих органы человека. Патогенными для человека считаются M.pneumoniae (вызывает респираторный микоплазмоз), M.arthritidis (с ней связывают заболевания суставов - артриты) и группа генитальных микоплазм M.hominis, M.genitalium, M.fermentans и U.urealyticum , вызывающих поражение мочеполовых органов. В последнее время появились результаты исследований, показавших что наличие генитальных микоплазм приводит к различным нарушениям в течении беременности, вплоть до преждевременного прерывания и гибели плода. Возможно и инфицирование новорожденных микоплазмами при родах с развитием у них воспалительных процессов в верхних дыхательных путях.
МИКОПЛАЗМОЗ У СОБАК И КОШЕК.
Известно и классифицировано более 30 видов микоплазм, из них многие патогенны для животных и являются возбудителями различных болезней. Заболевания отмечены у крупного рогатого скота, овец, коз, свиней, птиц, собак, кошек, львов, мышей, крыс, от которых выделены патогены. Патогенность микоплазм — их свойство продуцировать гемолизины, эндотоксины и другие продукты жизнедеятельности, которые определяют патогенез. Под влиянием этих продуктов в организме развиваются различные патологические состояния. В инфекционный процесс вовлекаются органы дыхания, молочная железа, суставы, гениталии, нервная система, мочевыводящие пути. Развитие инфекционного процесса зависит от особенностей возбудителя и организма восприимчивого животного. Патогенность удается также выявить в случае заражения культуры тканей. На основании изучения ЦПД делаются попытки классифицировать микоплазмы на 3 группы: первая группа - сапрофиты, которые не размножаются в культуре ткани, вторая — контаминанты, которые присутствуют в ткани, но слабо репродуктивны, третья — патогенные формы, вызывающие ЦПЭ в ткани.
Локализация микоплазм в организме животных преимущественно на слизистых дыхательной и мочеполовой системы, в суставах.
К микоплазмам, выделенным у мелких домашних животных, относятся М. Felis и М. Gatae – у кошек и M. Cynos – у собак.
Устойчивость этих организмов во внешней среде не велика, по отношению к человеку они являются сапрофитами и в большинстве случаев не представляют опасности. Микоплазмы часто входят в состав постоянной флоры слизистых оболочек верхних дыхательных путей, желудочно-кишечного тракта, половых путей и могут представлять собой оппортунистические организмы, вызывая системную инфекцию при иммунодефиците, иммуносупрессии и онкологических заболеваниях. При микоплазмозах часто наблюдается вторичная бактериальная инфекция – фиброзный экссудат, характерный для инфекционного процесса, защищает микоплазмы от антител и антимикробных препаратов и способствует хронизации воспалительного процесса. Кроме того, микоплазмы способны включать антиген клеток хозяина в свою плазмалемму, а белковый антиген микоплазм может включаться в плазмалемму клетки хозяина, в результате чего нарушается механизм иммунной защиты.
У собак наиболее часто диагностируют урогенитальные заболевания, вызванные представителями Mycoplasma и Ureaplasma, которые в норме встречаются в мочеполовой системе здоровых животных. Передача происходит, как правило, половым путем, но возможен и воздушно-капельный путь передачи.
При тяжелых микоплазмозах возможно рассасывание эмбрионов, абортирование, щенки рождаются недоразвитыми, наблюдается высокая неонатальная смертность в первые дни. У сук регистрируются рецидивирующие вагиниты, устойчивые к классическому лечению, выкидыши, мертворожденность; у кобелей – баланопоститы, уретриты, простатиты, орхоэпидидимиты, отек мошонки, снижение фертильности. Дыхательные пути поражаются микоплазмой только у маленьких щенков или у животных с поражением ресничного аппарата бронхов (дискинезия ресничного эпителия). Микоплазменная инфекция суставов (хронический фибринозно-гнойный полиартрит, тендосиновит) может развиться в результате распространения микроорганизмов из очагов активной или латентной инфекции со слизистых оболочек дыхательных путей, мочеполового тракта, конъюнктивы. Характерна для ослабленных животных и животных с иммуносупрессией. Клинически это проявляется в виде хронической перемежающейся хромоты, нежелании двигаться, болями в суставах, отеках и опухании суставов, возможно, с лихорадкой и общим недомоганием. Инфекция, вызванная М. Spumans, ассоциирована с синдромом полиартрита у молодых грейхаундов.
У кошек выделены несколько видов микоплазм, наиболее часто встречаются Mycoplasma felis и M. Gatae. Инфекция распространена как в больших колониях кошек, так и среди животных домашнего содержания, причем микроорганизм выделен как от больных, так и от здоровых кошек. Присутствие в верхних дыхательных путях и на конъюнктиве кошек М. Gatae естественно, хотя, возможна, она и имеет в этих местах небольшой патогенный потенциал. При конъюнктивите и болезнях верхних дыхательных путей патогенная роль отводится М. Felis. По данным зарубежной литературы частота выявления микоплазм на слизистых оболочках здоровых кошек достигает 70%, у кошек с коньюнктивитами – до 25% случаев. Предполагается, что М. Felis может быть патогенной, а М. Gatae – комменсалом. Не доказано, что микоплазмы в виде моноинфекции являются причиной заболеваний верхних дыхательных путей, хотя в сочетании с другими микроорганизмами они более патогенны для кошек, чем для собак. В большинстве случаев поражение микоплазмозом проявляется в виде серозного ринита и чихания. Тем не менее в случае выделения микоплазмы из дыхательных путей кошек показана специфическая антибиотикотерапия.
В сочетании с хламидиями, герпесом и иммунопатиями микоплазмы могут быть причиной конъюнктивитов. Конъюнктивиты с участием микоплазм сопровождаются блефароспазмом, отеком и покраснением конъюнктивы, слезотечением, появлением катарального или гнойного отделяемого. В большинстве случаев симптомы исчезают через 7-10 дней.
Маститы. При патологии молочных желез выделяются микоплазмы agalactiae var, а также апатогенные виды, вызывающие субклинические формы заболевания молочной железы.
Уреаплазмы - бактерии семейства Mycoplasmatacea. Уреплазмы в отличие от микоплазм содержат уреазу и гидролизуют мочевину в аммоний и углекислый газ, культивируют при рН 6,0 и образуют весьма мелкие колонии, которые представляют собой сферические образования, размером от 0,25 до 1 мкм. Располагаются они одиночно, парами или короткими цепочками.
Своеобразие биологии уреаплазм проявляется и в их относительно быстром росте.
Продолжительность инкубационного периода при остром микоплазмозе может колебаться от 3 дней до З -5 недель, иногда до 2 мес. Есть данные, что средняя продолжительность инкубационного периода при воспалении мочеиспускательного канала - уретры -составляет 19 дней. Микоплазмы часто обнаруживают при хронических гинекологических заболеваниях: вагинитах, бартолинитах, цервицитах, эндометритах, воспалительных процессах в брюшной полости. В ассоциации с другой микрофлорой мико - и уреаплазмы участвуют в формировании бактериального вагиноза. Бессимптомные формы (или микоплазмоносительство) не сопровождаются реакцией организма в форме воспаления. При полноценном иммунитете носительство может продолжаться неограниченно долго без отрицательных последствий для организма, в котором микоплазмы персистируют (но носитель может быть источником передачи инфекции половым партнёрам. При ослаблении иммунитета (причины которого могут быть различными - неполноценное питание, переохлаждение, стресс, общее заболевание, беременность, роды, аборты и т.д.) носительство перестаёт быть бессимптомным, появляются признаки воспаления и развивается заболевание. Есть данные, что приблизительно 40% всех воспалительных заболеваний мочеполовых органов вызываются микоплазмами. Адаптируясь к длительному существованию в условиях конкретного организма, мико - и уреаплазмозы трудно поддаются лечению, часто рецидивируют, приводят к осложнениям.
Воспалительные процессы в половых органах, вызванные уреаплазмами, могут привести к нарушению функций репродуктивной системы вплоть до полного отсутствия возможности зачатия. Обширные статистические данные свидетельствуют о том, что уреаплазмы играют роль при абортах и преждевременных родах. В большинстве случаев обнаружение этих микроорганизмов в моче беременных соотносится с патологией беременности, в частности, с рождением щенков с низкой массой тела. У таких новорожденных бронхолегочная патология уреаплазменной природы обусловлена внутриутробным их инфицированием. Плод заражается внутриутробно.
При подозрении на клинически значимый микоплазмоз (преимущественно у ослабленных животных и животных с иммуносупрессией) показано применение антибактериальных препаратов, которые влияют на синтез ДНК, РНК, белков и целостность клеточных мембран. Ряд тетрациклинов , макролидов , фторхинолонов , линкозаминов и аминогликозидов . Урогенитальные микопалзмы наиболее чувствительны к доксициклину , тетрациклину и джозамицину . Наиболее низкая чувствительность - к ципрофлоксацину и эритромицину . Не последнюю роль в терапии микоплазмоза и сопутствующих инфекций играет применение иммуномодуляторов, повышающих сопротивляемость организма.
В силу изначально сапрофитной природы микоплазмоза и высокой приспосабливаемости микоплазм к иммунной атаке организма стерилизовать организм относительно микоплазмоза практически невозможно, можно лишь контролировать репродукцию и агрессивность возбудителя в организме.
Семинар лаборатории ШАНС -БИО
лекции Кирьянов Е. А. Микоплазмы и Л-формы бактерий в патологии животных.
Уреаплазмозы – комплексные болезни домашних и диких животных, птиц и человека, вызываемые различными видами уреаплазм, сопровождающиеся патологией половой, мочевыделительной, респираторной, иммунокомпетентной систем, поражением глаз, воспалением желудочно-кишечного тракта, анемией и желтухой, а также артритами и артрозами.
Этиология
Уреаплазма – одноклеточный полиморфный микроорганизм (прокариот) с трехслойной цитоплазматической мембраной вместо клеточной стенки, имеющий нетипичную ДНК.
Спектр восприимчивых биологических объектов: коровы, козы, овцы, свиньи, кошки, собаки, крысы, хомяки,птицы (куры, индейки и др.), человек.
Инкубационный период уреаплазмоза длится около одного месяца, зависит от исходного состояния здоровья животного или человека. Уреаплазма относится к внутриклеточным микроорганизмам.
Научная классификация:
Царство: Bacteria
Отдел: Firmicutes
Класс: Mollicutes
Порядок: Mycoplasmatales
Семейство: Mycoplasmataceae
Семейство Mycoplasmataceae объединяет представителей родов Mycoplasma, Acholeplasma, Spiroplasma, анаэроплазмы и Ureaplasma, включающих патогенные и сапрофитические виды.
Род Ureaplasma имеет 6 видов, которые в основном паразитируют в организмах млекопитающих животных, людей и птиц. Виды не обладают строгой хозяиноспецифичностью.
Ureaplasma caniginitalium – носители кошки, человек;
Ureaplasma cati встречается у кошек, собак и человека;
Ureaplasma felinum встречается у кошек;
Ureaplasma diversum – носители крупный рогатый скот (КРС), кошки, крысы;
Ureaplasma urealyticum и Ureaplasma parvum (отличаются, в основном, в ПЦР) паразитируют на мембранах слизистой оболочки мочеполовой системы и на слизистой оболочке зева и глотки человека, а также крупного рогатого скота (на слизистой оболочке половых органов, зева и конъюнктиве), у собак и обезьян;
Ureaplasma gallorale встречается у птиц и кошек.
Уреаплазмы имеют ряд особенностей, уникальных для прокариот: простая организация клетки с минимальным количеством органелл; отсутствие клеточной стенки; самое низкое соотношение гуанин + цитозин пар оснований в ДНК и наименьший среди прокариот размер генома (0,5–1,0 MДa).
Электронно-микроскопически дифференцированы 3 типа U. urealyticum:
- малые (120–150 нм) с гомогенной цитоплазмой и множеством рибосом; средние (500–750 нм)
- с рибосомами по периферии;
- большие – с оптически более плотной негомогенной цитоплазмой и выраженным нуклеоидом.
Уреаплазмы не имеют клеточной стенки, а значит рецепторов и некоторых «индивидуальных» структурных особенностей клеточной мембраны, благодаря которым организм животных, человека и птиц может формировать против них полноценный иммунитет.
Значительный полиморфизм паразитов способствует очень частому образованию новых форм, что так же затрудняет развитие иммунного ответа.
Иммунодефициты, обусловленные уреаплазмами, связаны и с нетрадиционным поведением бактериофагов, которые, поглотив их, вместо переваривания и нейтрализации разносят по всему организму, способствуя развитию патологических процессов, отдаленных от первичного очага поражения, в т. ч. в почках, суставах. Уреаплазмы поражают и гемолизируют эритроциты. Благодаря отсутствию оболочки, могут сливаться с клетками макроорганизма и встраивать в их генетический аппарат фрагменты своей ДНК с образованием генетически чужеродных для макроорганизма структур – антигенов.
Иммунный ответ хозяина становится направленным на свои, но уже измененные клетки, возникает аутоиммунный процесс, который будет усугублять общее состояние инфицированного организма с каждым рецидивом болезни. Обмен генетической информацией между уреаплазмами и микроорганизмами, заключенными в матрикс бактериальной биопленки, а также с планктонными клетками приводит к образованию хозяиноспецифичных мутантных уреаплазм с измененными антигенными детерминантами, параметрами роста и к экспрессии специфичных иммунных генов.
Уреаплазмы часто находятся на слизистых оболочках совершенно здоровых животных и людей. Во влагалище здоровых женщин их находят в 60 % случаев, а у новорожденных девочек в 30 % случаев. До 80 % половозрелых людей, имеющих несколько партнеров, являются носителями этого микроорганизма. Уреаплазмы могут годами жить в организме, не вызывая какой-либо симптоматики. Но в экстремальных ситуациях происходит активное увеличение численности возбудителя, что формирует воспалительный процесс в месте их обитания.
Один из главных факторов защиты организма – нормальная микрофлора, являющаяся физиологическим барьером. В неблагоприятных условиях нарушается баланс микроорганизмов (дисбактериоз), что способствует развитию уреаплазменной патологии. У млекопитающих животных уретра (мочевыводящий канал) и эпителий дыхательной системы имеют наиболее благоприятные условия для развития этой инфекции. Уреаплазмы, обладающие ярко выраженными адгезивными способностями, не смываются током мочи и затем проникают в толщу ткани. Клетки разрушаются как под действием непосредственно уреаплазмы, так и из-за «неадекватного» поведения иммунной системы, которая начинает уничтожать собственные ткани. При этом развитие патологии происходит очень быстро.
Факторы патогенности уреаплазм
- Поверхностные компоненты клеток (адгезины), связывающие клетки микроорганизма с клетками-мишенями макроорганизма. Играют решающую роль в развитии начальной стадии процесса;
- Протеазы U.urealyticum расщепляют IgA человека на 2 фрагмента, по массе соответствующих Fc- и Fab-фрагментам. В результате воздействия протеаз иммуноглобулины теряют способность связывать антигены уреаплазм и предотвращать развитие инфекции;
- Фосфолипазы мембраны уреаплазм А1, А2 и С. При инфицировании плода и плаценты они видимо гидролизуют фосфолипиды мембраны клеток плаценты, что приводит к увеличению количества свободной арахидоновой кислоты и к активации синтеза простагландинов;
- Уреаза U. urealyticum гидролизует мочевину с образованием аммиака, оказывающего токсический эффект на клетки-мишени.
Уреаплазмоз птиц
Вызывает Ureaplasma gallorale, впервые выделенная от кур. От индеек уреаплазмы изолировали при низкой выводимости индюшат. Имеются сообщения о возникновении фибринозного аэросаккулита у индюшат и цыплят, экспериментально зараженных уреаплазмой, изолированной от больных индеек. При проведении филогенетического генотипирования установлено, что Ureaplasma gallorale, изолированная от цыплят, наиболее близка изолированному от человека Ureaplasma Urealyticum, чем к другим видам уреаплазм. Сведения о выявлении болезни у других видов птиц крайне ограничены.
Уреаплазмоз крупного рогатого скота (КРС)
Характеризуется пневмониями у телят и хроническим течением с воспалением половых органов и бесплодием у взрослых животных. Возбудитель болезни – Ureaplasma diversum. По серологическим свойствам различают 11 сероваров, дифференцированных на 3 группы: А, В, С. Представители группы В и А чаще выделяются от коров с признаками вульвовагинита и бесплодия. Из серогруппы С – главным образом отмечаются в сперме быков.
Инфекция в большинстве случаев протекает энзоотически. Взрослые животные чаще заражаются через мочеполовые органы. Возбудитель может быть занесен в стадо с контаминированной спермой. Телята заражаются аэрогенно или через инфицированные родовые пути при отеле. Уреаплазмы передаются через контаминированную спермой подстилку и при гинекологическом исследовании животных.
Уреаплазмы у быков выделяют: из препуция в 30–100 % случаев, из спермы в 24–46 %, из половых органов коров в острой стадии болезни в 100 %, в хронической стадии болезни – до 75 % случаев. При бесплодии у коров – в 30% случаев, от клинически здоровых коров – в 20% случаев.
Телята обычно болеют в 1–3-месячном возрасте. Отмечается повышение температуры тела, ухудшение аппетита, одышка, учащенный пульс. При прогрессировании болезни дыхание становится прерывистым, затрудненным, сопровождается стонами. Телята стоят с широко расставленными грудными конечностями.
У коров в острой стадии болезни происходит обильное выделение гнойного экссудата из влагалища, засыхающего на волосах хвоста в виде корочек и чешуек. Слизистая оболочка влагалища гиперемирована, на ее поверхности выявляется большое количество мелких ярко-красных узелков, придающих ей шероховатость. При хроническом течении количество выделяемого экссудата меньше, но узелковая сыпь на слизистой оболочке влагалища сохраняется. У быков при пальпации отмечают набухание семенных пузырьков и придатков семенника.
Патологоанатомические изменения у павших или вынужденно убитых телят – очаги катаральной или катарально-гнойной пневмонии, в основном в верхушечных и сердечных долях легких, у коров – катаральный, катарально-гнойный эндометрит и сальпингит, а у быков – везикулит и эпидидимит.
Уреаплазмоз собак и кошек
Как правило, протекает бессимптомно. Возбудители находятся в теле до 80 % обследованных собак, часто без клинического проявления болезни. Но при снижении иммунитета, вызванном неполноценным кормлением, переохлаждением, заболеванием какой-либо этиологии, беременностью, родами, абортом или иным стрессом может развиться клинически выраженное острое течение болезни. Возникают проблемы с глазами, органами репродуктивной системы и дыхания, реже артриты и артрозы, воспаление ЖКТ.
Промежуточные стадии уреаплазм развиваются в эритроцитах и разрушают последних с появлением тяжелой анемии и желтухи. Симптомы уреаплазмоза зависят от конкретного вида возбудителя, его «локализации», состояния иммунной системы зараженного животного.
Если уреаплазма первоначально поразила репродуктивную систему, то у животных могут наблюдаться эндометриты, уретриты, возможно развитие пиометры и т. д. Уреаплазмы кошек и собак в той или иной степени опасны для человека, в т. ч. способны вызывать аборты и бесплодие.
По данным ВОЗ, не менее чем у 27 % пар, содержащих кошек-бактерионосителей, отмечаются проблемы с зачатием ребенка.
Культивирование
На плотных питательных средах образуют разные по величине и морфологии колонии: мелкие, напоминающие яичницу-глазунью, с диаметром 10–30 мкм, и крупные, диаметром 175–200 мкм. Колонии чаще грубо гранулярные, с отсутствующим или едва заметным центральным бугорком, но на соответствующих средах становятся гладкими и приобретают типичный вид «глазуньи». Ureaplasma на дифференциально-диагностической среде А-7, содержащей, кроме дрожжевого экстракта и лошадиной сыворотки, мочевину и соли марганца, образует псевдоколонии в виде коричневого преципитата непосредственно над колониями. Псевдоколонии возникают в результате взаимодействия ионов Мп2+ с продуктами гидролиза уреаплазмой мочевины.
В жидких средах Ureaplasma вызывает незначительное помутнение или опалесценцию; некоторые штаммы растут с образованием тончайшей жировой пленки.
Для роста и размножения желательны многокомпонентные среды, содержащие стеролы, предшественники нуклеиновых кислот, как минимум 12 аминокислот и витамины группы В.
Оптимальные условия: температура для роста 35–37 °С, рН 6,0–6,5. В антигенном отношении уреаплазмы неоднородны. В структуру их мембран входит холестерин, поглощаемый бактерией из тканей макроорганизма. Не восстанавливают диазокрасители, сахара не разлагают. Не редуцируют тетразол, каталазной активностью не обладают. Синтезируют насыщенные и ненасыщенные жирные кислоты. Продуцируют продукт пуринового обмена – пигмент гипоксантин. Имеют бета-гемолизин, позволяющий гемолизировать эритроциты кроликов и морских свинок. Ureaplasma spp. способны синтезировать уреазу, гидролизирующую в качестве источника энергии мочевину с образованием аммиака и углекислого газа. Размножаются в основном делением, но способны к сегментации и почкованию.
Диагностика
Микроскопическое выявление уреаплазм, имеющих очень маленькие размеры, не эффективно.
Микробиологическое выделение возбудителя из материала на искусственной питательной среде позволяет с максимальной вероятностью определить точный вид возбудителя и «протестировать» его на чувствительность к антибактериальным препаратам.
Способность уреаплазм секретировать уреазу позволяет легко дифференцировать их от прочих микоплазм. В настоящее время метод определения уреазной активности (образование аммиака из мочевины) – один из основных способов диагностики уреаплазмозов. Этиологическая диагностика, т. е. выделение возбудителя, приобретает особое значение в связи с невозможностью отличить по клинической картине уреаплазмоз от хронической гонореи.
ПЦР (полимеразная цепная реакция) отличается высокой чувствительностью и позволяет точно выявить наличие ДНК возбудителя в патматериале и определить персистирующие, некультивируемые формы уреаплазм. Положительный результат соответствует выявлению диагностического количества (концентрация мико/уреаплазм более 104 кл/мл свидетельствует о возможном развитии уреаплазмоза). В случае подозрения на персистенцию мико/уреаплазм для установления диагноза рекомендуется проводить ПЦР-определение до 3-х раз с определенным интервалом. Это связано с тем, что численность мико/уреаплазм при персистенции в организме невелика и колеблется от 103 до 105 кл/мл (в зависимости от напряженности иммунитета, стрессов, переохлаждения и пр.). Чувствительность ПЦР-тест-систем – 104 кл/мл, поэтому в пробах, взятых у одного пациента в разное время, без лечения, уреаплазмы могут обнаруживаться, или отсутствовать, либо снова выявляться. В связи с высокой генетической изменчивостью мико/уреаплазм для выбора праймеров при создании ПЦР-тест-систем используется наиболее консервативный участок генома – гены рибосомальной РНК (16S rRNA). Чувствительность тест-систем для выявления мико/уреаплазм составляет не менее 10 000 кл/мл пробы биоматериала (не менее 100 молекул ДНК в 5 мкл обработанной пробы, вносимых в амплификационную смесь), а специфичность – 99 %. Перспективным направлением лабораторной диагностики мико/уреаплазм является молекулярная диагностика – детекция активности генов, ответственных за фенотипическое проявление факторов патогенности. Положительный результат в ПЦР-исследовании и отрицательный в посеве может свидетельствовать о персистенции возбудителя. ПЦР не выявляет количество возбудителя в исследуемом материале, поэтому положительный результат при ПЦР не является основанием для назначения лечения, а сам метод не может использоваться для контроля его эффективности после завершения лечения.
Серологические методы имеют лишь ориентировочное значение, т.к. выявляют только наличие антител к инфекционному агенту, а зависимость между титром специфических антител и присутствием возбудителя отсутствует. Серологическое типирование уреаплазм не нашло широкого распространения, поскольку многие серовары перекрестно реагируют с антисыворотками и от одного пациента можно выделить микроорганизмы различных серовариантов. ИФА и МФА выявляют лишь присутствие антител, их диагностическая ценность пока лишь 50–75 %. Окончательный диагноз ставится только на основании полного клинического обследования, включая анализы крови, мочи и кала.
Лечение и профилактика
Вакцины и другие средства специфической профилактики не разработаны. При лечении хорошо себя зарекомендовали мощные антибиотики из группы тетрациклинов и другие. Сульфаниламидные препараты для лечения пока не используются. Даже при хорошей реакции на терапию возможен рецидив, поэтому важно пролечить животное полным курсом препарата, пусть даже при наличии у последнего побочных эффектов. Нестероидные противовоспалительные препараты (мази при лечении конъюнктивита) применяют крайне осторожно. При их неправильном нанесении возможно распространение очага поражений по большей площади конъюнктивы.
При уходе за больными животными и людьми нужно строго соблюдать меры личной гигиены, инфицированных и подозреваемых в заболевании собак и кошек не подпускать к маленьким детям и беременным женщинам.
Автор:
В. А. Бакулин, доктор ветеринарных наук, профессор кафедры микробиологии, вирусологии и иммунологии Санкт-Петербургской государственной академии ветеринарной медицины, академик Международной академии наук экологии, безопасности человека и природы, Санкт-Петербург

Изжога это неприятное ощущение в грудной клетке, сопровождающееся чувством жжения, иногда болью, а также появлением неприятного привкуса во рту. Возникает изжога из-за заброса в пищевод соляной кислоты, которая вырабатывается в желудке для переваривания пищи. Стенки слизистой пищевода гораздо нежнее, чем в желудке, поэтому из-за агрессивного воздействия соляной кислоты появляется ощущение боли и жжения. При выборе средства от изжоги необходимо учитывать причины ее появления.
Изжога: причины возникновения
Изжога - это один из самых часто встречаемых симптомов со стороны пищеварительного тракта, с которым пациенты приходят к врачу. Однако симптом не всегда сопровождает болезни органов пищеварения. Например, у здорового пациента изжога может возникнуть на фоне приема пищи, которая стимулирует образование кислоты. Также она может появиться после физической нагрузки, оказывающей влияние на повышение внутрибрюшного давления. Но при этом изжога беспокоит пациента редко. Если же симптом появляется чаще одного раза в неделю, это уже является поводом для обращения к врачу,
Причины появления изжоги:
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ).
Язвенные поражения желудка и двенадцатиперстной кишки, хронический гастрит, онкологический процесс в желудке.
Расстройства желчного пузыря, поджелудочной железы, печени.
Заболевания сердечно-сосудистой системы.
Хронические заболевания легких.
Патологические состояния, сопровождающиеся асцитом, метеоризмом, ожирением и иными факторами, повышающими внутрибрюшное давление.
Беременность, на фоне которой также оказывается давление на органы брюшной полости.
Прием некоторых препаратов.
Погрешности в диете и неправильное питание (злоупотребление жирной, сладкой, острой пищей, газированных напитков).
Особенности работы, связанные с подъемом тяжестей из наклонного положения тела.
При наличии любого заболевания или состояния требуется назначение лечения, для чего необходимо обратиться к врачу для проведения обследования и подбора схемы лечения.
Особенности терапии
Лекарственное средство от изжоги подбирает врач, оценив состояние пациента и причины ее появления. Длительность лечения, терапия, дозировка подбирается в индивидуальном порядке.
Многие пациентов интересует вопрос – как избавиться от изжоги быстро? Снятие симптома производится с помощью, как домашних средств, так и медикаментозных.
Домашние средства от изжоги
Если мучает изжога, как избавиться в домашних условиях – это наиболее актуальный вопрос. Ряд продуктов способствует облегчению состояния:
Сода. Это самое популярное средство в народной медицине, позволяющее устранить изжогу методом гашения кислоты в желудке, но положительный эффект от данного метода не длительный. Врачи не рекомендуют данный тип нейтрализации изжоги, так как он является опасным, и злоупотреблять им точно не стоит. При частом ее применении сода может изменить полностью кислотность желудка, и навредить процессам метаболизма.
Йогурт с пробиотиками. Данный продукт обладает противовоспалительным свойством за счет тех компонентов, которые присутствуют в йогурте. К тому же этот продукт является легким по своему составу, и содержит большое количество белка. Протеины связывают кислотные элементы желудка, поэтому соляная кислота в меньшем объеме попадает в пищевод. Главное выбирать йогурт без содержания сахара и красителя, так как сладкий продукт напротив усилит ощущение изжоги.
Молоко. Данный продукт рекомендован при появлении изжоги и предназначен для ее гашения. Средство действительно работает, так как действует оно механически, устраняя кислоту со стенок пищевода. Также в молоке присутствует белок и противовоспалительные вещества. Однако это средство не подходит лицам с непереносимостью лактозы.
Мятный чай. Данный напиток обладает спазмолитическим действием и успокаивает желудок. Соответственно облегчается состояние пациента с изжогой. Но у многих людей наблюдается усиление изжоги из-за расслабления сфинктера пищевода, в результате чего соляная кислота попадает в большем количестве. Поэтому метод подходит не всем.
Что выпить или съесть от изжоги? Этим вопросом часто задаются люди, страдающие неприятным симптомом. Перечисленные средства являются более щадящими, но при регулярно повторяющихся приступах изжоги рекомендована консультация врача.
Лекарственные средства при изжоге
Медикаментозные препараты, устраняющие симптомы изжоги, относятся к группе альгинатов и антацидов.
Антациды - это группа медикаментов, нейтрализующая активность соляной кислоты. К данной группе относятся препараты:
Данные препараты снижают активность соляной кислоты и подавляют повышенное ее образование через некоторое время.
Альгинаты. Данная группа препаратов способствует образованию на поверхности слизистой особой гелевой пленки, которая защищает от агрессивного действия кислоты.
Некоторые препараты характеризуются двойным действием, то есть сочетают в себе и антацидный эффект, и альгинатный.
Блокаторы H2 гистаминовых рецепторов. Эти лекарственные средства сокращают выработку соляной кислоты, при этом не нарушают процессы пищеварения. Длительность эффекта продолжается в течение 12 часов, и при этом нет необходимости принимать дополнительные средства.
Препарату прокинетики. Применяются в тех случаях, когда имеются нарушения моторной функции желудка, что способствует ускорению переваривания пищи и ее эвакуации в тонкий отдел кишечника. На фоне приема данных препаратов усиливается моторика желудка.
Профилактика изжоги
Чтобы не задаваться вопросом, что помогает от изжоги, необходимо предотвратить повторное ее появление. Это возможно сделать с помощью простых методов. Необходимо снизить нагрузку на желудок, и соблюдать следующие рекомендации:
Прием пищи небольшими порциями 4-5 раз в день.
Исключение из рациона соленых, жирных или острых блюд.
Отказ от еды перед сном.
Поддержание двигательной активности после приема пищи.
Исключение из рациона газированных напитков.
Снижение избыточного веса.
Исключение вредных привычек.
Из гардероба необходимо убрать одежду с тугими поясами.
Самостоятельно заниматься лечением изжоги можно лишь в некоторых случаях - когда она беспокоит редко. Если же симптом возвращается чаще одного раза в неделю, необходимо пройти обследование. Прием препаратов должен производиться под контролем врача в строго рекомендованных дозах.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Авторизуйтесьчтобы оставлять комментарии
Возрастные ограничения 18+
Обзор
С чувством комка в горле сравнивают ощущение, когда трудно глотать или что-то мешает в горле. Медицинское название этого симптома — дисфагия.
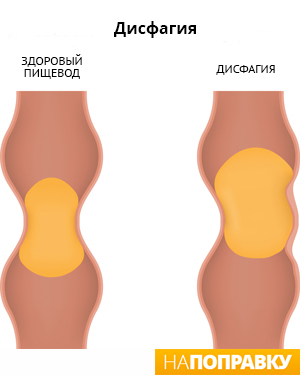
Практически каждый из нас чувствовал «комок в горле» при страхе, сильном волнении или плаче. Неприятные ощущения и боль в горле являются самыми красноречивыми признаками ангины. Однако, если человеку становится трудно глотать пищу, слюну или напитки, это может быть признаком более серьезного заболевания, поэтому следует обязательно обратиться к врачу.
Чувство комка в горле без нарушения акта глотания не считается дисфагией и не рассматривается в этой статье. Такое возможно при стенокардии (болезни сердца), гипертиреозе (болезни щитовидной железы), истерии (нервно-психическом расстройстве) и др.
У некоторых людей неприятные ощущения возникают только в момент проглатывания твердой пищи. В более тяжелых случаях человек неспособен проглотить даже жидкий напиток или слюну. Другими признаками дисфагии являются:
- кашель, поперхивание во время еды и питья;
- отрыжка пищей, иногда через нос;
- ощущение, что что-то мешает в горле;
- со временем наблюдается потеря веса, чаще происходят заболевания
дыхательных путей.
В зависимости от причины нарушения глотания дисфагия может развиваться на уровне ротоглотки или пищевода. В зависимости от этого, существуют различные способы лечения. Иногда, устранив причину затруднения глотания, удается полностью вернуть человеку способность полноценно питаться. В более тяжелых случаях применяют методы, облегчающие прием пищи, например, введение зонда в желудок или обучают больного новой технике глотания.
Комок в горле: причины дисфагии
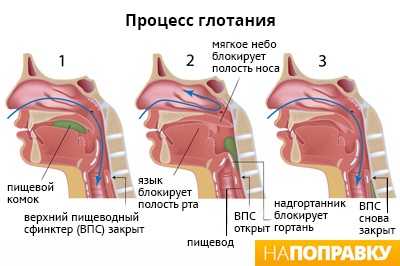
Глотание — это сложный процесс, нарушать его могут самые различные факторы. Иногда это возрастные изменения глотательных мышц, которые развиваются у пожилых людей. В старшем возрасте проблемы с глотанием относительно широко распространены. Тем не менее, возрастную дисфагию не следует воспринимать как естественную часть процесса старения. Существуют определенные средства для лечения.
Другой причиной дисфагии могут быть различные хронические заболевания, например, хроническая обструктивная болезнь легких (ХОБЛ). Иногда становится трудно глотать после хирургической операции на голове или шее, что является осложнением лечения. Причинами трудностей при приеме пищи могут быть сухость во рту или язвы во рту.
Ниже описаны наиболее распространенные ситуации, когда возможно появления постоянного чувства комка в горле.
Неврологические причины дисфагии
Слово «неврологический» означает «связанный с нервной системой». Она состоит из головного, спинного мозга и нервов. Поражение нервной системы может нарушать работу нервов, ответственных за процесс глотания, что проявляется трудностями при приеме пищи. Неврологические причины дисфагии включают в себя:
- инсульт;
- болезнь Паркинсона, рассеянный склероз, деменция и болезнь двигательных нейронов;
- опухоль мозга;
- тяжелая миастения — редкое заболевание, вызывающее слабость мышц.
Врожденные заболевания и нарушения развития ребенка
Врожденные заболевания — это болезни, уже имеющиеся при рождении ребенка, нарушения развития — это отклонения в его развитии. Дисфагию могут вызывать следующие из них:
- нарушения обучаемости — когда ребенку сложно учиться, усваивать новую информацию и общаться с другими людьми;
- детский церебральный паралич (ДЦП) — группа неврологических заболеваний, нарушающих движение и координацию ребенка;
- расщелина губы и нёба — распространенный врожденный порок развития — «заячья губа» или «волчья пасть».
Непроходимость (обструкция) глотки и пищевода
Заболевания, вызывающие обструкцию (непроходимость) глотки, гортани или сужение пищевода, могут затруднять глотание. Некоторые причины обструкции:
- рак полости рта или горла, например, рак гортани или пищевода — после успешного лечения рака обструкция проходит;
- лучевая терапия — метод уничтожения раковых клеток с помощью радиоактивного излучения, после чего могут оставаться рубцы, сужающие просвет гортани или пищевода;
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — заболевание, при котором происходит затекание желудочного сока из желудка в пищевод, что вызывает образование рубцов, которые суживают просвет пищевода;
- инфекционные заболевания, такие как туберкулез или кандидоз, которые вызывают воспаление пищевода (эзофагит).
Болезни мышц как причина дисфагии
Дисфагию могут вызывать любые заболевания, поражающие мышцы, проталкивающие пищу по пищеводу в желудок, однако такие болезни встречаются редко. С нарушением глотания связаны:
- склеродермия — заболевание, при котором иммунитет (защитная система организма) атакует здоровые ткани, что вызывает повреждение мышц гортани и пищевода;
- ахалазия пищевода — мышцы нижнего отдела пищевода не достаточно расслабляются, поэтому еда и жидкости не проходят в желудок.
Комок в горле: диагностика дисфагии
Если становится трудно глотать слюну или пищу, необходимо обратиться к терапевту или педиатру (с ребенком). Врач проведет первичный осмотр и может направить вас к специалисту для дополнительных обследований и лечения. Цель обследований — определить, вызвана ли дисфагия проблемами в области рта, горла, или причина трудностей при глотании кроется в области пищевода.
Врач спросит вас о следующем:
- как долго наблюдается дисфагия;
- вам трудно глотать постоянно, или жалобы возникают периодически;
- трудности бывают при проглатывании твердой пищи, жидкой или того и другого;
- потеряли ли вы в весе.
Ниже описаны возможные виды обследований.
Тест с проглатыванием воды позволит сформировать первоначальное представление о глотательной способности пациента. Выдается 150 мл воды, которую нужно выпить как можно быстрее. Специалист засечет время и количество глотков, за которые вода будет выпита. Вместо воды могут попросить съесть йогурт или фрукт.
Видеофлюроскопия — рентгеноскопическое исследование акта глотания с помощью бария. Это одна из наиболее точных диагностических процедур для оценки глотательной способности. Исследование глотания с помощью бариевой взвеси зачастую позволяет выявить непроходимость пищевода.
Человек садится перед рентгеновским аппаратом. Затем его просят проглатывать различные продукты и напитки, смешанные со специальной нетоксичной жидкостью под названием бариевая взвесь. Барий — контраст, который будет светиться в рентгеновских лучах. Аппарат непрерывно записывает движущееся изображение на видео, позволяя подробно изучить процесс глотания.
Исследование занимает около 30 минут. После него можно есть и пить как обычно, но может потребоваться больше воды, чтобы вымыть барий из организма. Иногда после исследования слегка тошнит. Также барий вызывает запор. Кроме того, в течение нескольких следующих дней стул может быть белым, пока барий не выйдет из организма полностью. Перед процедурой можно есть и пить как обычно.
Манометрия — это исследование, позволяющее оценить работу пищевода. Для этого через нос в пищевод водится тонкая трубка (катетер) с датчиками давления, которые измеряют давление внутри пищевода при глотании. Это поможет определить, нормально ли работает пищевод.
Суточное мониторирование рН заключается в измерении кислотности в желудке и пищеводе на протяжении суток с помощью катетера, введенного через нос. Это позволяет определить, сколько кислоты затекает в пищевод из желудка, и может помочь в диагностике причины дисфагии.
Диагностическую гастроскопию также называют диагностической эндоскопией желудка или эзофагогастродуоденоскопией (ФГДС, ФГС, ЭФГДС). Это осмотр внутренних органов при помощи эндоскопа. Эндоскоп — это длинная тонкая гибкая трубка с источником света и видеокамерой на одном конце. Он вводится в пищевод по горлу и передает полученное изображения на монитор. ФГС позволяет исключить раковые новообразования или рубцы на слизистой, сформировавшиеся из-за гастроэзофагеальной рефлюксной болезни (ГЭРБ). Эндоскопия также может проводиться для лечения, например, чтобы растянуть пищевод при помощи надувного баллона или бужа (тонкого гибкого медицинского инструмента). Также в ходе процедуры может быть установлен стент — расширитель.
Оценка питания. Если дисфагия мешает потреблению пищи, может потребоваться провести оценку питания, чтобы проверить, нет ли нехватки питательных веществ (истощения). Для этого измеряют вес и рост, рассчитывают индекс массы тела, проводят анализ крови.
Комок в горле: лечение дисфагии
В большинстве случаев с трудностями при глотании можно справиться. Лечение подбирается в зависимости от того, вызвано ли заболевание нарушениями в области рта или горла — ротоглоточная дисфагия или в области пищевода — пищеводная дисфагия. Иногда лечение первопричины, например, рака ротовой полости или пищевода, помогает облегчить глотание. В лечении могут принимать участие различные специалисты.
Лечение ротоглоточной дисфагии
Если человеку трудно глотать из-за неврологических заболеваний, то возможности лечения этого вида дисфагии ограничены, так как значительная часть заболеваний нервной системы плохо поддается терапии. Существуют три основных направления лечения ротоглоточной дисфагии: изменение рациона, переобучение глотанию, зондовое кормление.
Диетолог (специалист по питанию) помогает избавиться от трудностей при глотании и ощущения комка в горле с помощью оптимизации рациона. Рекомендуется перейти на мягкую и полужидкую пищу, которую легче проглатывать. Облегчить процесс принятия пищи может добавление к продуктам лимонной кислоты.
Большое значение имеет обучение технике проглатывания пищи с помощью специальных упражнений. Они укрепляют глотательные мышцы. Кроме того, в процессе переобучения глотанию врач использует стимуляцию вкусом и температурой пищи.
Если дисфагия выражена значительно, может потребоваться переход на зондовое питание. Зонд для искусственного кормления позволяет принимать пищу, пока не вернется глотательная способность. Он также может быть необходим в тяжелых случаях дисфагии при угрозе истощения и обезвоживания. Кроме того, зонд упрощает прием лекарств, необходимых для лечения других заболеваний.
Различают два типа зондов для искусственного кормления:
- трубка, которая проводится в желудок через нос или рот назогастральный зонд;
- трубка, которая проводится сквозь переднюю брюшную стенку напрямую в желудок — гастростома.
Назогастральный зонд предназначен для временного использования, примерно через месяц ее необходимо сменить и ввести через другую ноздрю. Гастростому менять не нужно, она подходит для длительного применения. Большинство людей с дисфагией предпочитают гастростомы, так как их можно скрыть под одеждой, однако риск осложнений при их использовании выше.
Легкие осложнения включают в себя смещение стомы, кожную инфекцию, нарушение проходимости стомы, а тяжелые — внутреннюю инфекцию и кровотечение. После использования гастростомической трубки сложнее вернуться к нормальному питанию. Из-за удобства такой трубки человеку может не хотеться выполнять глотательные упражнения и менять свой рацион.
Лечение пищеводной дисфагии
Иногда дисфагию можно лечить дома при помощи лекарств (в зависимости от ее причины). Например, блокаторы протонного насоса помогают снять воспаление и спазм пищевода при гастроэзофагеальной болезни, эзофагите и других расстройствах пищеварения. При ахалазии пищевода применяют нитраты, блокаторы кальциевых каналов, спазмолитики и другие средства. Все эти лекарственные препараты могут оказаться бесполезными, если использовать их не по назначению. Поэтому пить таблетки от дисфагии можно только по назначению врача.
Ботулотоксин иногда назначают для лечения ахалазии — заболевания, при котором мышцы пищевода становятся слишком жесткими и не дают пище и жидкости попадать в желудок. В эти мышцы вводят ботулотоксин, чтобы парализовать их. Однако эффект процедуры сохраняется лишь около полугода.
Эндоскопическая дилатация — это хирургическая операция, широко распространенная для лечения дисфагии, вызванной непроходимостью. С ее помощью также можно растянуть пищевод, если в нем образовалась рубцовая ткань. Эндоскоп вводится в пищевод через горло и передает изображение на монитор. Руководствуясь этим изображением, врач вводит надувной баллон или буж (тонкий гибкий инструмент) в узкую часть пищевода, чтобы расширить его. Баллон постепенно надувают, чтобы он растянул пищевод, а затем спускают и достают.
Перед эндоскопической дилатацией вам могут дать слабое успокоительное. Во время выполнения процедуры существует небольшой риск разрыва или прокола пищевода.
Стентирование пищевода. При неоперабельном раке пищевода вместо эндоскопической дилатации обычно рекомендуют стентирование, так как рак увеличивает риск разрыва пищевода при растяжении. Стент (обычно трубка из металлической сетки) устанавливается в пищевод во время эндоскопии или под контролем рентгеновского аппарата. Затем он постепенно расширяется, чтобы создать достаточно обширный проход для пищи и жидкости. Чтобы стент не забивался, необходимо соблюдать определенную диету.
Лечение дисфагии у детей
Если ребенок рождается с затруднением глотания (врожденной дисфагией), лечение будет зависеть от причины заболевания. При детском церебральном параличе (ДЦП) ребенка учат глотать, выбирать правильные продукты и пользоваться зондом для искусственного кормления. Расщелина губы и нёба — врожденный дефект лица, который может мешать процессу глотания. Обычно он устраняется хирургическим путем. Сужение (стеноз) пищевода исправляется при помощи дилатации — хирургической операции по расширению пищевода (см. выше).
При дисфагии у детей, вызванной гастроэзофагеальной рефлюксной болезнью (ГЭРБ), нужно использовать специальные густые смеси для кормления вместо грудного молока или обычного детского питания. Иногда также назначается лекарственное лечение.
Осложнения при дисфагии
При дисфагии существует риск, что пища, напиток или слюна попадут «не в то горло», перекрыв дыхательные пути. Из-за этого человеку становится трудно дышать, он кашляет или давится. Прочитайте об этом подробнее в разделе «Что делать, если человек подавился?».
Если из-за дисфагии вы часто давитесь едой, это повышает риск развития аспирационной пневмонии. Это инфекционное заболевание дыхательных путей, возникающее при случайном вдыхании инородных объектов, например, частичек пищи, что приводит к раздражению или повреждению легких. Пожилые люди особенно уязвимы перед этим заболеванием.
Симптомы аспирационной пневмонии:
- кашель — как сухой, так и с мокротой, которая может быть желтого, зеленого или коричневого цвета или содержать следы крови;
- температура 38° C или выше;
- боль в груди;
- затрудненное дыхание — вдохи частые и неглубокие, возможна одышка даже во время отдыха.
При развитии этих симптомов необходимо немедленно обратиться к врачу. Аспирационная пневмония лечится антибиотиками. В тяжелых случаях требуется госпитализация в больницу. Прочитайте подробнее о лечении пневмонии. У очень пожилых людей или людей со слабым здоровьем инфекция может вызвать заполнение легких жидкостью, из-за чего они не могут нормально работать. Это называется острой дыхательной недостаточностью. Риск развития пневмонии выше при хронической обструктивной болезнью легких (ХОБЛ) или несоблюдении правил гигиены полости рта.
У ребенка дисфагия может приводить к недостаточному питанию и истощению, что сказывается на его физическом и умственном развитии. Дети, которым что-то мешает в горле, могут испытывать стресс во время приема пищи, что становится причиной отклонений в поведении.
К какому врачу обратиться, если что-то мешает в горле?
Если вам трудно глотать пищу и беспокоит чувство комка в горле, найдите терапевта или педиатра (для ребенка). Врач общего профиля проведет первичное обследование, чтобы исключить наиболее распространенные причины нарушения глотания. Затем, в зависимости от предполагаемой причины дисфагии вас могут направить на обследование к следующим специалистам:
- отоларингологу (специалисту по болезням уха, горла и носа) — если проблема в ротоглотке;
- неврологу (специалисту по болезням нервов, головного и спинного мозга) — если проблема в нервной регуляции глотания;
- гастроэнтерологу (специалисту по заболеваниям пищеварительной системы) — если дисфагия вызвана болезнями желудочно-кишечного тракта;
- онкологу (специалисту по лечению опухолей) — в случае подозрения на опухоль глотки или пищевода.
Выбрать врача нужной специальности вы можете с помощью нашего сервиса, перейдя по вышеуказанным ссылкам.
Возможно, Вам также будет интересно прочитать

Localisation and translation prepared by Napopravku.ru. NHS Choices provided the original content for free. It is available from www.nhs.uk. NHS Choices has not reviewed, and takes no responsibility for, the localisation or translation of its original content
Copyright notice: “Department of Health original content © 2020”
Все материалы сайта были проверены врачами. Однако, даже самая достоверная статья не позволяет учесть все особенности заболевания у конкретного человека. Поэтому информация, размещенная на нашем сайте, не может заменить визита к врачу, а лишь дополняет его. Статьи подготовлены для ознакомительной цели и носят рекомендательный характер.
Читайте также:

