Что за болезнь у собак нлш
Опубликовано: 16.05.2024
Перевод статьи американского ветеринарного врача Джеффа Видта, который несколько десятилетий занимался проблемами наследственной лихорадки шарпея. Перевод - Елена Иващенко.
- 1. Клинические проявления
- 2. Патогенез наследственной лихорадки шарпея
- 3. Лабораторные исследования
- 4. Лечение НЛШ
- 5. Колхицин
- 6. Предотвращение НЛШ
- 7. Контроль
- 8. Осложнения НЛШ
- 9. Диагностика НЛШ
- 10. Будущее в исследовании проблемы НЛШ
- 11. Рекомендации владельцам шарпеев с НЛШ
Наследственная лихорадка шар-пея (FSF/НЛШ) - генетическое воспалительное заболевание, присущее этой породе. Это заболевание передается по аутосомально-рецессивному пути. Т.е. для того, чтобы у шар-пея проявилось это заболевание, оба родителя должны передать ему рецессивные "больные" гены.
Клинические проявления НЛШ
Эпизодическая лихорадка - наиболее яркий и весомый признак наличия этого заболевания у шар-пея. Лихорадка проявляется в повышении температуры до 39,4 - 41,7 С, но в некоторых случаях возможна и более высокая температура. Она имеет "самоограничение" - длится 12-36 часов, если в этот период времени не дать жаропонижающее. Другой распространенный симптом FSF, который сопровождает повышение температуры - опухание суставов, чаще всего - скакательных суставов (голень). Этот яркий симптом FSF называют синдромом отека скакательных суставов. Опухание довольно болезненно для собаки, кожа в месте опухания на ощупь горячая. Помимо скакательных суставов (или вместо них) отечность может проявиться на лодыжках, запястьях или губах. Собака с приступом FSF ведет себя в точности как больная собака - она передвигается с неохотой, походка становится неуклюжей. Это часто сопровождается болями в брюшном отделе, что заставляет собаку выгибать спину.
Патогенез наследственной лихорадки шарпея
Вот, что на сегодняшний день известно о НЛШ:
1. У шар-пея с НЛШ повышенный уровень цитокин интерлейкина-6 (IL-6). IL-6 непосредственно вовлечен в процесс "ответа" организма на лихорадку и является важной частью запускающего механизма производства печенью С-реактивного белка (один из белков острой фазы, кол-во которых резко возрастает при воспалительных процессах в организме). IL-6 так же включен в синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome - SIRS). Разрегулирование уровня IL-6 - это прямое последствие FSF. IL-6 также играет очень важную роль в реакциях организма на стресс и служит "заправщиком" иммунной системы.
2. У шар-пея с FSF очень высок риск ранней гибели от системного амилоидоза. У примерно 25% собак с FSF развивается почечный амилоидоз, который ведет к почечной недостаточности. У небольшой части собак с FSF развивается печеночный амилоидоз. Как правило амилоидоз обеих форм возникает у шар-пеев 2-5 лет. Кроме того шар-пеи с FSF в большей степени подвержены иммуно-опосредованным заболеваниям почек, таким как мембранный гломерулонефрит, протеинозависимые формы гломерулопатии. Эти собаки подвержены таким формам тромбоэмболии как: мезентерическая эмболия, селезеночная эмболия, легочная эмболия. Наиболее редким, но и наиболее чудовищным последствием FSF может стать синдром токсического стрептококкового шока (Streptococcal Toxic Shock Syndrome (STSS).
3. Долгое время предполагалось, что наследственная лихорадка шар-пея является собачьей формой человеческой Наследственной Средиземноморской лихорадки (FMF). Последние исследования доказывают, что это не так, тем не менее FSF очень похожа на FMF.
4. FSF - семейно-наследственное заболевание на генетической основе. Оно, по всей видимости, передается по аутосомально-рецессивному пути.
Лабораторные исследования:
К сожалению, пока не существует анализов крови и т.д., по которым можно определить FSF. Во время самих эпизодов лихорадки в анализах крови можно увидеть: повышенный уровень белых кровяных телец (лейкоцитов); повышенный уровень ферментов печени и другие не специфические изменения. Все попытки изучения ДНК больных собак так же пока не дали ни какого результата.
Лечение:
Очень важно постоянно следить за температурой тела собаки, у которой уже был приступ лихорадки шар-пея. В ситуации лихорадки, когда температура повышена, для ее снятия используется аспирин. Собаке дается полная взрослая доза аспирина каждые 6 часов в первые 24 часа от начала лихорадки, а затем - дважды в день еще 3-5 дней. В редких случаях, когда аспирин не работает, при экстремально высокой температуре дается дипирон (dipyrone). Некоторым пациентам во время лихорадки необходима поддерживающая терапия в виде внутривенных вливаний (капельницы), а в особо серьезных случаях - экстренная помощь - точно такая же как при тепловом ударе. Антибиотики при лихорадке шар-пея обычно не требуются.
Колхицин:
Колхицин - это человеческое лекарство, которое прописывается больным FMF для предотвращения развития амилоидоза. С той же целью мы рекомендуем его и шар-пеям с FSF. Официальных исследований, которые полностью бы доказывали действенность колхицина у шар-пеев с FSF, до сих пор нет. Однако клиническая практика показывает, что оно помогает. Колхицин не снимает вероятность возникновения очередного приступа лихорадки, но он сглаживает ее течение и препятствует развитию последствий. На данном этапе исследований побочные эффекты при приеме колхицина выглядят минимальными: в основном они касаются желудочно-кишечных расстройств, таких как рвота, диарея, анорексия (снижение аппетита), и т.п.
Предотвращение:
Симптомы лихорадки шар-пея проявляются лишь время от времени, спорадически. Лихорадка возникает, когда включаются "запускающие" ее механизмы. Одним из самых сильных механизмов является стресс. Стрессовая ситуация может быть любой - дрессировочная площадка, выставка, поход к ветеринару, течная сука (для кобеля), чрезмерные занятия и нагрузки, другие болезни и т.д. Если владелец сможет выяснить эти запускающие лихорадку механизмы и сможет оберегать свою собаку от них, количество эпизодов лихорадки значительно сократится. Что касается диеты, она, по всей видимости, не играет ни какой роли в предотвращении или развитии лихорадки шар-пея и сопутствующей почечной недостаточности. Разумеется, диета важна для собаки с почечной недостаточностью, но ни какое питание не даст гарантии предотвращения почечной недостаточности у шар-пея с наследственной лихорадкой. Терапия небольшими дозами аспирина может помочь в уменьшении силы лихорадки и ее частоты появления. Аспирин также может быть полезен в сопутствующей терапии по предотвращению тромбоэмболии.
Контроль:
Контроль за осложнениями, которые обычно сопутствуют FSF - одна из важнейших задач владельца собаки, у которой хотя бы однажды была лихорадка шар-пея. Самое частое и последовательное осложнение наследственной лихорадки шар-пея - почечная недостаточность в результате иммуно-обусловленной почечной болезни или почечного амилоидоза. Я рекомендую каждые 3 месяца делать анализы мочи. На анализ берется первая утренняя моча с условием, что собака в последний раз пила накануне вечером. Я прежде всего смотрю на показатели, которые измеряют концентрацию мочи (цвет и плотность) и уровень белка в моче. Когда почки начинают сдавать, первым признаком является потеря способности производить концентрированную мочу, и она становится очень светлой и снижается ее плотность (сигналы полиурии - повышенного выделения воды). Эти признаки появляются раньше, чем наступают изменения почечных показателей в биохимических анализах крови. Увеличение потребности в воде (усиленная жажда, собака начинает пить больше, чем обычно), обильное мочеиспускание - это тоже клинические симптомы, указывающие на то, что почки собаки теряют способность к концентрации мочи, однако эти первые признаки остаются безо всякого внимания. Я считаю, что было бы разумным делать полный анализ крови и мочи каждому шар-пею раз в 6 месяцев. И уж тем более надо делать анализы крови, если анализы мочи показывают какие-то отклонения. Важно также периодически взвешивать собаку, контролируя ее вес, т.к. снижение веса - тоже клинический симптом развития почечных проблем. Мы часто не замечаем даже серьезной потери в весе собаки из-за того, что эта потеря растянута во времени и, по этой причине, не бросается в глаза. Если у вашей собаки уже был приступ лихорадки шар-пея, внимательно следите за ее аппетитом, колебаниями веса и жаждой. Увеличение потребления жидкости при сниженном аппетите и снижении веса - серьезные сигналы.
Осложнения НЛШ:
Помимо почечных осложнений течения НЛШ, о которых говорилось выше, клинически задокументированы следующие последствия лихорадки шар-пея: тромбоэмболия (брыжечная, селезеночная, легочная), синдром диссеминированной внутрисосудистой коагуляции (свертывания), синдром системной воспалительной реакции, синдром множественного функционального поражения внутренних органов (дисфункции сразу нескольких жизненно важных органов), синдром токсического стрептококового шока (т.н. "стрептококк, поедающий плоть"), повышение кровяного давления, связанное с почечной недостаточностью. Эти осложнения являются главной причиной смерти шар-пеев после остро протекавших приступов лихорадки. Ни один приступ лихорадки шар-пея не должен лечиться поверхностно, простым снятием температуры и отека!
Диагностика НЛШ:
К сожалению, до сих пор не придумано специальных тестов и анализов, которые позволили бы диагностировать FSF. Диагностика FSF основывается на клинических проявлениях приступов лихорадки у шар-пеев. Я считаю, что каждый умерший шар-пей должен быть подвергнут аутопсии (вскрытию) для установления причины смерти, но это особенно важно в том случае, если у него были в течение жизни приступы FSF. Почечный амилоидоз может быть диагностирован только на основании биопсии и окрашивания тканей в краситель "Congo Red". Этот краситель специфично реагирует на присутствие в тканях депонированного амилоидного белка. Амилоидный белок может быть обнаружен и в тканях других органов шар-пея, поэтому требуйте проведения экспертизы с помощью этого красителя всех тканей, взятых на гистопатологический анализ. Во взятых образцах тканей собак с FSF не всегда можно обнаружить амилоидный белок. Однако это не означает, что у данных собак не идет процесс депонирования амилоидного белка, это означает лишь то, что во взятом образце его нет, либо то, что он начнет накапливаться позже. Еще большая путаница в диагностике происходит от того, что не все шар-пеи с амилоидозом выказывают признаки наследственной лихорадки. Кроме того, пристыпы лихорадки могут быть настолько смазанными, что их примут за обычное повышение температуры или просто не обратят на них внимания. Приступы могут быть очень редкими, они могут происходить в ваше отсутствие, когда шар-пей сидит дома один или когда он находится на передержке у заводчика, и т.д. Все это делает диагностику и своевременное взятие болезни под контроль крайне тяжелыми. Это печально, учитывая, что таких собак по незнанию могут пускать в разведение и получать потомство больных собак или собак-носителей этой генетической проблемы.
Будущее в исследовании проблемы НЛШ:
На факультете ветеринарной медицины при Мичиганском Университете уже давно проводятся исследования по разработке специального теста ДНК крови, с помощью которого можно было бы определить наличие паталогического гена FSF у конкретного шар-пея. Руководит этим проектом доктор ветеринарных наук Гари Джонсон. Некоторое время назад считалось, что лихорадка шар-пея является аналогом семейной средиземноморской лихорадки у человека, однако исследования в этом направлении зашли в тупик: ген средиземноморской лихорадки удалось идентифицировать в ДНК человека в 1997 году, после чего были предприняты тщетные попытки выявить аналогичный ген у шар-пеев. Как оказалось, генные мутации, отвечающие за наследование средиземноморской лихорадки у человека, у собак отсутствуют. Это означало, что несмотря на внешне сходство и последствия, лихорадка шар-пея и человека - это два разных генетических заболевания. Существует еще ряд генетических воспалительных заболеваний человека, например, семейная ирландская лихорадка, механизмы которой, по мнению моей коллеги, Линды Тинтл, могут быть идентичными с FSF. Работа по обнаружению генных мутаций, ответственных за FSF продолжается.
Когда наконец-то работа по созданию теста на FSF будет завершена, появится возможность создать масштабную программу по определению больных собак, собак-носителей и генетически чистых особей. Я считаю, что все питомники должны будут провести экспертизу своих собак с тем, чтобы постепенно свести на нет это генетическое заболевание, отбирая для разведения только здоровых производителей. Одна из самых больших сложностей сейчас - невозможность даже определить фенотип собаки, пораженной FSF. Нет ни определенного возраста, в котором проявляются признаки FSF (первые приступы могут начаться уже после того, как собаку допустят в разведение), сами клинические проявления могут быть очень разными, у каких-то собак в следствие FSF развивается амилоидоз, у каких-то - нет. Все это делает чрезвычайно сложной генетическую селекцию шар-пеев по FSF, поскольку метод определения здоровых и больных собак по фенотипу (внешним признакам) очень часто не работает.
Рекомендации владельцам шарпеев с НЛШ:
Все шар-пеи с FSF должны пожизненно принимать колхицин и регулярно проходить проверку по анализам мочи и крови на предмет развития вероятных осложнений (прежде всего - почечных). Собаки с FSF ни в коем случае не должны использоваться в разведении (лучше всего их стерилизовать). Собаки, чьи родители или дедушки-бабушки поражены FSF, должны принимать колхицин и проходить проверку по анализам крови и мочи. Собак с FSF крайне необходимо оберегать от любых стрессов.
Если эта беда случилась с вашей собакой, распечатайте этот текст и дайте его прочесть вашему ветеринарному врачу.
Этот материал предоставлен для перевода и публикации на данном сайте доктором ветеринарной медицины, президентом ветеринарного комитета "The Health Through Education" Американского Национального Шар-пей Клуба, практикующим ветеринарным врачом Джеффом Видтом. На протяжении последних 20-ти лет др. Видт - одна из ключевых фигур в изучении наследственных болезней шар-пеев в США. Все личные высказывания, содержащиеся в этой статье, принадлежат ее автору, я лишь перевела этот текст, сделав его, по возможности, немного понятнее для простых читателей. С уважением, Елена Иващенко.
Аллергия у шарпея
Как проявляется аллергия у шар-пея. Что может стать причиной аллергии у собаки. Что такое пищевая аллергия у шарпея: ее симптомы. Об этом читайте в статье.
Почечная недостаточность (ХПН) у шарпея
Большая статья, описывающая симптомы, диагностику и поддерживающее лечение собаки с почечной неостаточностью. Как распознать ХПН на ранних стадиях. Что делать, если болезнь прогрессирует.
Как подстричь собаке когти
Большинство собак, которые много гуляют, сами стачивают когти, а потому не нуждаются в специальной обрезке. Однако это не относится к щенкам и малоактивным шарпеям. И для многих владельцев стрижка когтей у питомца - настоящий квест.
О пользе голодания для шарпея

Многие хозяева собак очень волнуются, если их питомцы отказываются от еды. У шар-пеев это вообще не редкость - вчера наелся до отвала, а сегодня вообще не подходит к миске - что за напасть? Главное - без паники. Дело в том, что периодические "разгрузочные дни" естественны для физически здоровой собаки. Более того - они важны не меньше, чем хорошая еда. И что самое удивительное - пост полезен не только здоровым, но и больным четвероногим.
Почему мы терпим неудачу в воспитании собаки

Нам кажется, что если мы как следует изучим теорию воспитания собаки, то применить ее на практике уже не будет проблемой. Мы с энтузиазмом беремся за дело и. терпим неудачу. Почему? Секрет расскрывает знаменитый кинолог и ветврач Gwen Bohnenkamp.
Наследственная лихорадка шарпея (далее НЛШ) является аутовоспалительным (не путать с аутоиммунным) заболеванием. Основной генетический дефект заключается, чаще всего, в нарушении восприятия источников воспаления, что приводит к постоянному (хроническому) повышению уровня этих медиаторов (химических веществ, молекулы которых способны реагировать со специфическими рецепторами клеточной мембраны и изменять её проницаемость для определённых ионов) в крови. Этот периодический лихорадочный синдром характеризуется сильным повышением температуры, иногда сопровождаемый отеком, и обычно длится 24-36 часов.
Согласно последним исследованиям, это сложное расстройство включает в себя несколько интерактивных генетических мутаций, включая найденную ранее в геноме человека средиземноморскую лихорадку
Шар-пей может иметь аномальное начало воспаления (повышение температуры), а также усиление других мутаций. Тяжесть этих расстройств и риск возникновения амилоидоза будет варьироваться от количества воспалительных реакций и их аутовоспалительной чрезмерной реакции.
Фоновое хроническое воспаление увеличивает риск развития реактивного системного амилоидоза, который может привести к преждевременной смерти от почечной недостаточности. Конечно, не у каждой собаки с НЛШ обязательно разовьется амилоидоз, но лихорадки свидетельствуют о том, что имеются нарушения и высокий риск возникновения почечной недостаточности. Шарпей с НЛШ МОЖЕТ жить 10 и более лет. Два шарпея моей матери с НЛШ прожили 12 ½ и 15 ½ лет. Делая все возможное для ослабления хронического воспаления и контролируя болезнь, вы можете помочь своей собаке прожить долгую и счастливую жизнь.
Ветеринар, как правило, ставит диагноз НЛШ после исключения других возможных причин для лихорадки. Для этого проводятся диагностические тесты по состоянию вашей собаки, наиболее распространены: общий анализ мочи (по первой утренней порции), клинический анализ крови, биохимический анализ крови, Т4, проверка на ряд заболеваний, передаваемых клещами. Возможно, могу понадобиться и другие тесты, включая тесты на аутоиммунные заболевания. Сейчас диагностика этого заболевания проводится методом исключения, но ученые ведут разработки новых методов диагностики генетических мутаций, включая ДНК-диагностику.
Поскольку повышение температуры – показатель наличия аутовоспалительного заболевания, для предотвращения осложнений лечение следует начать как можно раньше. Некоторые собаки умирают от амилоидоза, хотя наблюдаемый случай лихорадки был единичным – количество и частоту случаев лихорадки не следует связывать с тяжестью, лежащих в их основе хронических воспалений.
При лихорадке шарпея я рекомендую 0,025-0,03 мг/кг колхицина дважды в день. Я рекомендую начинать лечение с низкой дозировки и постепенно повышать ее до максимальной рекомендуемой дозировки, которую ваша собака может переносить без желудочно-кишечных расстройств (обычно, это диарея). Для шарпея среднего веса дозировка составляет одну таблетку с дозировкой 0,6 мг два раза в день.
Колхицин это сильнодействующее лекарство, но он накапливается в белых кровяных клетках, что и является желаемой целью в лечении, и признаки желудочно-кишечных расстройств проявляются задолго до других серьезных побочных эффектов.
Я никогда не видела доказательств какого-либо ущерба от колхицина, за исключением кратковременной диареи, легко поддающейся лечению отменой препарата.
Колхицин воздействует на патологию, лежащую в основе заболевания, блокируя движение нейтрофилов (одна из разновидностей белых кровяных клеток), снижая уровень цитокинов (агентов воспаления) и блокируя образование амилоидных белков (побочных отходов воспаления). В лечении людей доказано, что этот препарат безопасен для детей, беременных женщин и может применяться на протяжении всей жизни. Лечение на всю жизнь. Я использую препарат с 1993 года и у меня были отдельные пациенты, безопасно принимающие колхицин более 10 лет. Некоторые собаки не могут переносить колхицин, без хронической диареи, им понижается дозировка или препарат отменяется, если диарея не проходит. Колхицин и циклоспорина (Atopica) не должны применяться вместе, потому что возрастает риск подавления костного мозга.
В случае лихорадки я применяю 50% раствор анальгина инъекционно (как правило, 1,0 мл на собаку подкожно), или Метакам (мелоксикам, нестероидные противовоспалительные средства) по весу (см. инструкции). Некоторые случаи лихорадки очень серьезны и могут нуждаться в срочном ветеринарном вмешательстве – если температура вашей собаки 41 градус по Цельсию или выше. Вам следует обсудить лечение с ветеринаром, т.к. лечение лихорадки в более ранние сроки (в период воспаления) может остановить её до того момента как она станет опасной для жизни, поэтому лучше иметь необходимые для лечения препараты у себя дома. Не давайте нестероидные противовоспалительные препараты вместе с кортикостероидами, такими как преднизолон и тому подобные, и поставьте ветеринара в известность, если у вашей собаки началась рвота.
Текущие исследования показывают, что реактивное отложение амилоида и хроническое воспаление связаны с окислением холестерина и окисленых жирных кислот в клеточных мембранах. Поэтому я также рекомендую добавить к диете вашей собаки следующие антиоксиданты и другие добавки, чтобы компенсировать хроническое воспаление – этого скрытого убийцу:
1.50-100 мг альфа-липоевой кислоты один раз в день (не более 100 мг в день);
2. «человеческий» мультивитаминный комплекс хорошего качества (с A, D, E и полный B-комплекс витаминов);
3.по крайней мере 2000 мг омега-3 рыбьего жира (1-2 капсулы два раза или высококонцентрированный рыбий жир ½ -1 чайная ложка раз в сутки);
4.100-500 мг куркумина с биоперином в день с едой;
5.100-300 мг Boswellia дважды в день (Биологически активная добавка (БАД) Boswellia Plus (Босвелия Плюс)).
Питание должно быть хорошего качества, избегайте прогорклых полиненасыщенных, гидрогенизированных или транс-жиров. Колхицин может привести к снижению уровня витамина В12 (кобаламин) в организме, поэтому хороший комплекс витаминов B12 играет очень важную роль.
Витамин В12 важен в биохимических цепочках воспаления и его запасы в организме могут быть истощены из-за хронической болезни. Дефицит этого витамина может привести к хронической диарее и анемии легкой степени у некоторых шарпеев, поэтому я регулярно даю собакам по 1000 мкг витамина В12 в день. Недавние исследования показали, что оральный прием в организме человека является столь же эффективным, как и инъекционный и я наблюдала улучшение состояния собаки после приема пероральной терапии.
МСМ (метилсульфанилметан – органическая сера), как сообщается, уменьшает тяжесть лихорадки, но должна быть дополнена молибденом, если дается в высоких дозах (50-75 мкг / день, если доза МСМ>1000 мг в день).
100-200 мг ресвератрола в день могут уменьшить уровни IL-6 (интерлейкин 6 является одним из важнейших медиаторов острой фазы воспаления; мышцах и жировой ткани он стимулирует мобилизацию энергии, которая приводит к повышению температуры тела) и ослабить последствия цитокинового каскада (ресвератрол не следует применять вместе с кверцетином, так как последний блокирует его эффект).
Витамин K2 (menaquinone, MK7) также может подавлять IL-6 производимый фибропластами. Производство муцин (hyaluranon или HA) требует магния, и я часто назначают 200 мг магния (не оксида) в день после обнаружения гипомагнезии.
Вам следует регулярно делать анализ первой утренней мочи вашей собаки, а также клинический анализ крови, биохимический анализ крови, Т4 (гормон щитовидной железы). Моча низкой плотности это первый признак проблем с почками и, если анализ это обнаружил, необходимо его повторить, чтоб увидеть, постоянно ли моча собаки имеет низкий удельный вес.
Медуллярный амилоидоз является самой распространенной болезнью почек у шарпеев. Повышенное содержание белка в моче является симптомом поздней стадии заболевания, поэтому так важно регулярно сдавать анализ мочи, чтобы отслеживать уровень белка.
Следует сдать анализы и в том случае, если ваша собака с НЛШ неохотно ест или вовсе отказывается от пищи, если началась рвота или диарея, длящиеся более нескольких дней или если ваша собака испытывает недомогание – то есть в любом случае, когда собака «не в порядке». Даже здоровая и активная молодая собака должна быть проверена как минимум раз в год, остальные же собаки должны проверяться гораздо чаще.
Если вам тяжело дается материал, изобилующий медицинскими терминами, можно прочитать упрощенный вариант, где приводятся только конкретные рекомендации для владельца шарпея больного Наследственной лихорадкой шарпея.

Более 60% россиян содержат домашнее животное. Чаще всего люди заводят кошку или собаку. Собак в качестве домашних животных содержат более 14 веков. Многие исследования подтвердили положительное влияние домашних животных на человека. С одной стороны собаки оказывают положительное влияние на социализацию и психическое здоровье своих владельцев, но с другой – собаки играют важную роль в передаче вирусных, бактериальных, а также паразитарных инфекций человеку. Инфекционные заболевания могут передаваться человеку с зараженной слюной, инфицированной мочой или фекалиями и прямым контактом с собакой. Дети, пожилые люди, а также лица с ослабленным иммунитетом особенно подвержены повышенному риску инфицирования.
Инфекции, которые чаще всего передаются человеку от собак.
Кампиллобактериоз
Эта бактерия - самая распространенная причина развития гастроэнтерита у людей. Инфекция протекает чаще в легкой форме и прогноз заболевания благоприятный, но среди детей до года, а также у ослабленных лиц возможны тяжелые осложнения, приводящие к хронизации процесса или к летальному исходу. Кампиллобактериоз опасен для беременных: трансплацентарное заражение плода приводит к самопроизвольному аборту или внутриутробному заражению эмбриона.

Лептоспироз


Собаки выделяют возбудителя с мочой. Лептоспиры проникают в организм человека через кожные (чаще поврежденные) покровы, слизистые оболочки. Далее с током крови они разносятся по организму и попадают в различные органы. По частоте летальных исходов, множественности клинических симптомов - это заболевание занимает одно из первых мест, среди инфекционных заболеваний, передающихся человеку от животных
Листериоз

Возникает чаще всего у лиц пожилого возраста, новорождённых, у лиц с иммунодефицитами. В последние годы категорию риска дополняет большая группа лиц - зависимых от внутривенно вводимых наркотиков. У них листериоз часто приводит к смертельному исходу. Инфицированные животные выделяют бактерии во внешнюю среду со слюной, калом, мочой. Заболевание опасно для беременных.
Пастереллез

Острая инфекционная болезнь, характеризующаяся лихорадкой, общей интоксикацией, воспалением кожи, подкожной клетчатки, артритами, остеомиелитами. Заболевание опасно развитием септической формы, которая протекает наиболее тяжело с высокой вероятностью возникновения вторичных очагов в различных органах (эндокардит, абсцессы мозга, гнойный менингит, гнойные артриты и др.). Может развиться инфекционно-токсический шок.
Инфекции, вызываемые капноцитофагами

Возбудитель инфекции обитает в полости рта собак. Заражение человека происходит при укусах, царапинах и ослюнении. Факторы риска заболевания - аспления (врожденная или приобретенная патология, характеризующаяся отсутствием селезенки), длительный прием глюкокортикоидов, злоупотребление алкоголем. На фоне этих состояний течение инфекции приобретает молниеносный характер. Capnocytophaga canimorsus вызывает сепсис, менингит, инфекционный эндокардит, флегмону, гнойный артрит и другие угрожающие жизни осложнения.
Бешенство

Заболевание всегда заканчивается смертью. Заражение происходит через укусы, оцарапывание, ослюнение больными животными, при контакте с предметами, загрязненными инфицированной слюной.
Клещевой бореллиоз

Норовирусная инфекция

Ученым известно, что существует вероятность передачи норовирусной инфекции от собаки к человеку.
Стригущий лишай

Очаги облысения на волосистой части головы или розовые округлые пятна на остальных участках тела. От животного человек заражается при поглаживании шерсти. Дети заражаются стригущим лишаем от щенят, которых играя берут на руки. Прямой контакт необязателен – грибок стригущего лишая может сохраняться на предметах длительный период времени (от нескольких месяцев).
Токсокароз

Основным источником распространения инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена яйцами токсокар, а также при попадании в рот земли, в которой были яйца токсокар.
Из яиц, попавших в рот, далее в желудок и тонкий кишечник выходят личинки, мигрирующие по системе кровотока в печень. Там часть личинок оседают и вокруг них формируется воспалительная оболочка. Остальная часть личинок мигрирует в сердце и легкие. Личинки токсокар могут локализоваться в различных органах и тканях - почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, мигрируют и провоцируют рецидивы заболевания.
Одна из серьезнейших проблем, связанных с токсокарозом - взаимосвязь инвазии с развитием бронхиальной астмы.
Лямблиоз

Основные проявления лямблиоза –аллергические и патологические неврологические реакции
Эхинококкоз

Именно от собак человек чаще всего заражается эхинококкозом, заболеванием, вызываемым личинками ленточного червя (цестоды).
Передача возбудителя происходит при облизывании собакой человека, при контакте с шерстью животного.
Выделения зараженного пса попадают на траву, ягоды.
Попав в организм человека, яйцо, содержащее молодую личинку, мигрирует.
Личинки образуют круглые или овальные кисты, заполненные жидкостью, размером от 1-5 до 40 см и даже больше. Большая часть личинок задерживается в печени, часть попадает в легкие, а некоторые - в почки, кости и мозг. Личинка может попасть в любой орган, а киста может лопнуть и освободить еще десятки личинок. Вырастая, эхинококковая киста отодвигает и сдавливает ткани хозяина, которые впоследствии атрофируются и погибают.
Осложнения заболевания: нагноение кисты, плеврит, перитонит, механическая желтуха, цирроз, легочные кровотечения, сердечно-сосудистая недостаточность. Самое грозное осложнение - разрыв кисты, который сопровождается резкой болью и аллергической реакцией (анафилактический шок).
Собачий цепень (огуречный)

Огуречный цепень (лат. Dipylidium caninum), или собачий – гельминт являющийся возбудителем дипилидиоза. Взрослый червь паразитирует в организме собаки Заражение человека происходит при случайном проглатывания инфицированной блохи, собачьего власоеда или через слюну животных. В группе риска маленькие дети, вступающие в контакт с питомцами.
Чесотка
Инфекция, вызванная клещом Sarcoptes scabiei - внешним паразитом кожи животных. Чесоточные клещи могут передаваться от инфицированных собак людям

Характерные признаки заболевания - зуд и сыпь, часто с присоединением вторичных гнойничковых элементов вследствие инфицирования при расчесывании
Соблюдая простые правила, вы сможете оградить себя и своих близких от заражения
Первичные заболевания билиарной системы недавно были признаны более распространенными, чем считалось ранее. Однако сообщения о них по-прежнему редки.
Заболевания желчного пузыря (калькулезный и некалькулезный холецистит, мукоцеле, желчнокаменная болезнь, неоплазия и др.) достаточно трудно диагностировать у собак и кошек на ранних стадиях, так как симптомы неспецифичны и часто ассоциированы с обструкцией и/или воспалением общего желчного протока, воспалительными заболеваниями печени и др. Поэтому ранее они выявлялись в запущенной форме и подтверждались во время операции и/или аутопсии.
Помимо прогрессирующего ухудшения состояния животного, тяжело протекающий холецистит может приводить к разрыву желчного пузыря и последующему желчному перитониту. Все это требует проведения более тщательной диагностики у пациентов с симптомами, указывающими на холецистит, и индивидуального подхода при выборе лечения.
Холецистит – это воспаление желчного пузыря. Согласно этиологии выделяют три категории повреждений желчного пузыря: обструктивные, необструктивные и разрывы пузыря и/или желчных протоков, а также острую и хроническую формы протекания заболевания.
Обструктивный холецистит развивается чаще всего вследствие сдавления пузырного протока и/или холедоха измененной поджелудочной железой (в этом случае заболевание можно считать вторичным), реже – развития мукоцеле, сгущения желчи, неоплазии кишечника, печени, билиарного тракта, диафрагмальной грыжи и еще реже – образования желчных камней.
Необструктивные формы холецистита чаще всего связаны с наличием инфекционного очага в организме или с паразитарными заболеваниями (печеночная двуустка, лямблиоз и др.). Описанная в гуманной медицине первичная дискинезия желчного пузыря и желчевыводящих протоков как причина развития холецистита в современных ветеринарных источниках литературы не встречается. Возможно, это связано со сложностями в верификации диагноза и выявлением причин и механизма ее развития (у людей – это нарушения гормональной регуляции, стрессы, язвенная и желчнокаменная болезнь, заболевания поджелудочной железы, применение препаратов, вызывающих застой желчи и спазм сфинктера Одди). Дискинезию вторичного генеза так или иначе мы можем предполагать и наблюдать при сонографии желчного пузыря (перерастяжение, образование осадка в полости), при аномалиях развития желчного пузыря (перегибы, стенозы, перетяжки, неполные перегородки в полости пузыря) и после перенесенного ранее холецистита.
Пневмохолецистит (эмфизематозный холецистит) вызывается газообразующими бактериями, такими как E.coli или Clostridium perfringens. Часто наблюдается в сочетании с острым холециститом, сахарным диабетом и на фоне травматической ишемии желчного пузыря.
Разрывы желчного пузыря могут происходить при серьезных травмах (ДТП, падение с высоты, удары) или в результате перфорации измененной стенки желчного пузыря при хронических воспалительных процессах.
Согласно WSAVA Liver Standardization Group среди заболеваний желчного пузыря выделяют нейтрофильный, лимфоплазмацеллюлярный, фолликулярный холециститы, мукоцеле и инфаркты желчного пузыря.
Нейтрофильный холецистит часто наблюдается у кошек и реже у собак и, в общем, ассоциирован с бактериальной инфекцией; может наблюдаться как самостоятельное заболевание или в комбинации с нейтрофильным холангитом. Повреждение характеризуется появлением в полости пузыря, эпителии и стенке желчного пузыря нейтрофилов, при хроническом течении – смешанного воспалительного инфильтрата, содержащего нейтрофилы, лимфоциты, плазматические клетки.
Лимфоплазмацеллюлярный и фолликулярный холецистит возникают в результате формирования лимфоплазмацетарного инфильтрата и/или лимфоидных фолликулов в слизистой желчного пузыря.
Инфаркт желчного пузыря возникает вследствие окклюзии пузырной артерии. Полный или частичный инфаркт желчного пузыря описан у собак. При гистологическом исследовании наблюдают некроз всей толщи стенки желчного пузыря без признаков сопутствующего холецистита и (часто) тромбоз артерий.
Клинические симптомы
В большинстве случаев холецистит наблюдается как острое заболевание. Владельцы отмечают у животного тошноту, рвоту, отказ от корма, боли в области живота. Желтуха является необязательным симптомом, особенно если общий желчный проток свободен, и может проявляться не сразу. Ее появление в этом случае объясняется развитием неспецифического реактивного гепатита и внутрипеченочного холестаза в ответ на эндотоксины из воспаленного желчного пузыря. Холецистит, сопровождающийся застоем желчи, может приводить к ахолии и обесцвечиванию каловых масс. Появление на фоне этих симптомов лихорадки, синдрома острого живота и признаков септического шока (поверхностное дыхание, гипотермия, бледные десна и слабый, но частый пульс) может указывать на разрыв желчного пузыря и требует неотложных мероприятий.
Холецистит может быть хроническим и проявляться периодической тошнотой у животного, признаками дискомфорта после еды, потерей аппетита, снижением веса, диареей или протекать вообще без каких-либо симптомов (а изменения в желчном пузыре будут случайной находкой при ультрасонографии).
Диагностика
Данные анамнеза и физикального осмотра позволяют лишь предположить у животного описываемую патологию, но не дают возможности поставить диагноз. К тому же клиническая картина не отражает в полной мере степень поражения желчного пузыря, а соответственно, не позволяет определить наилучший способ лечения и прогноз заболевания.
На первом этапе диагностики обязательны клинический и биохимический (как можно более полный) анализы крови, факультативным исследованием является моча. Лабораторные тесты позволяют выявить увеличение щелочной фосфатазы, гиперхолестеролемию, гипербилирубинемию без признаков гемолитической анемии. Гипербилирубинемия приводит в конечном счете к билирубинурии. Повышение уровня желчных кислот, глутаматдегидрогеназы и лейкоцитоз очень характерны для данной патологии и дополнительно указывают на необходимость исследования желчи. Повышение трансаминаз будет выявлено только в случае вовлечения паренхимы печени в воспалительный процесс.
При выборе метода диагностики непосредственно холецистита предпочтение отдается визуальным исследованиям и преимущественно ультразвуковой диагностике. Рентгенография оказывается менее чувствительной при данной патологии и информативна только в случае кальцификации стенки желчного пузыря или формирования рентгеноконтрастных камней (Фото 6 и 7).
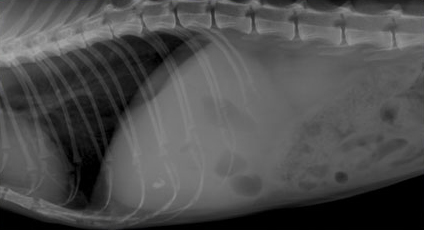
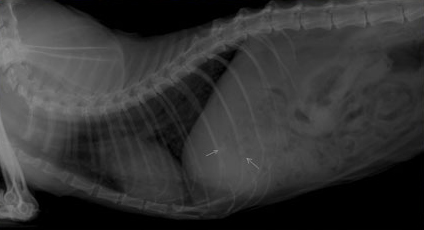
Фото 6 и 7.
В данном разделе мы рассмотрим изменения ультразвуковой картины желчного пузыря и билиарной системы, наблюдаемые при холецистите, не затрагивая возможные изменения поджелудочной железы, неоплазии других органов и т. д.
- Стенка желчного пузыря утолщается (толще 1 мм у кошек и 2-3 мм у собак), становится гиперэхогенной, с неровными краями – признак воспаления, отека (портальная гипертензия, гипоальбуминемия), некроза, гиперплазии слизистой пузыря, реже – неоплазии (Фото 1);
- Наряду с утолщением стенки часто отмечают появление двухконтурного ободка (особенно в более остром периоде) или диффузно гиперэхогенной стенки, иногда сочетающейся с минерализацией (при хронически протекающем процессе) (Фото 2 и 3);
- Утолщение стенки и дилатация просвета общего желчного протока, повышение его извитости. Однако бывает достаточно сложно дифференцировать дилатацию просвета на фоне обструкции от дилатации на фоне холестаза при хроническом воспалительном процессе. Кроме того, при хроническом нарушении оттока общий желчный проток может оставаться дилатированным даже после устранения обструкции (это необходимо учитывать в постоперационном обследовании);
- Появление желчного сладжа. Физиологически желчь может уплотняться и преобразовываться в желчный сладж (желчную грязь). Он представляет собой смесь слизи, билирубината кальция и кристаллов холестерина. В патологических условиях его консистенция и аккумуляция могут осложнить эвакуацию желчи во внепеченочные желчные протоки, что ведет к обструкции последних. Характерный признак желчного сладжа – изменение его вида на сканограмме в зависимости от изменения положения тела животного и медленное достижение нового горизонтального уровня (критерий подвижности сладжа позволяет отличить его от билиарного мукоцеле). Общим правилом является отсутствие дистальной акустической тени. Эхогенность сладжа может быть различной. Иногда сладж заполняет весь желчный пузырь, затрудняя дифференцировку между тканью печени и желчным пузырем. Эта ситуация называется "гепатизация желчного пузыря" (Фото 4 и 5);
- Желчное мукоцеле (муцинозная гиперплазия желчного пузыря) – характеризуется гиперплазией эпителия и сосочковыми разрастаниями, избыточным накоплением слизи, растягивающей желчный пузырь. Заболевание встречается редко, как правило, у собак мелких и средних пород (средний возраст — 9 лет). Является одной из причин развития обструкции внепеченочных желчных протоков и как следствие холецистита. По мере того, как формируется мукоцеле, на сканограмме вначале появляется звездчатый контур, затем поперечный срез желчного пузыря приобретает рисунок киви (фрукта) в поперечном сечении.
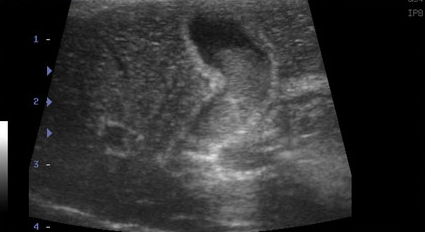
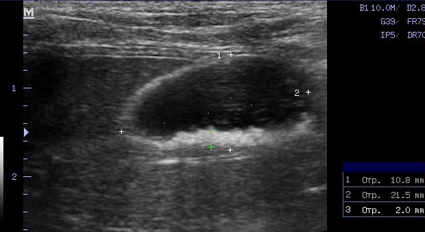
Фото 1 и 2.
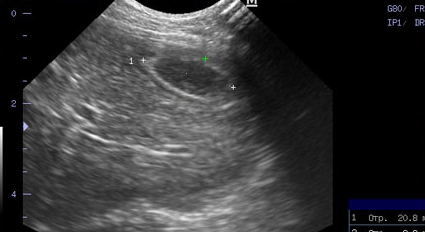
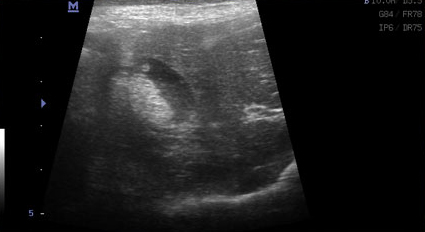
Фото 3 и 4.
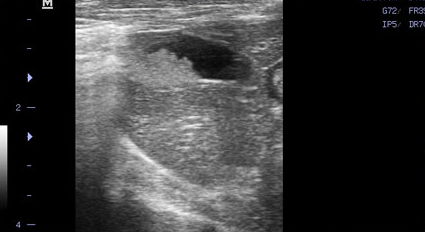
Фото 5.
При любом изменении желчного пузыря или появлении неоднородности желчи на УЗИ необходимо проводить тонкоигольную биопсию с целью аспирации желчи для цитологического и бактериологического исследований. Для этого можно использовать иглы 22-25-го номеров, и при проведении данной процедуры необходимо удалить столько желчи, сколько возможно, для предотвращения просачивания желчи через пункционное отверстие. Вероятность подобного осложнения крайне мала, в своей практике мы такого не встречали, но при наличии недиагностированной вовремя обструкции внепеченочных билиарных трактов риск повышается. Также мы рекомендуем проводить забор материала паренхимы печени для гистологического исследования (процедура забора биоптата для гистологического исследования усложняется ненамного в сравнении с тонкоигольной биопсией печени, но результат во много раз информативнее).
Одним из современных информативных методов является радионуклидное сканирование желчного пузыря (сцинтиграфия), которое позволяет оценить работу желчного пузыря, определить место обструкции протока. К сожалению, в нашей практике этот метод пока недоступен.
При подозрении на желчный перитонит показана диагностическая лапароскопия или лапаротомия.
Лечение
Выбор между терапевтическим и хирургическим методом лечения при данном заболевании осуществляется на основании комплексной оценки состояния животного, наличия сопутствующих заболеваний в анамнезе, наличия заболеваний, спровоцировавших развитие холецистита и, конечно, тяжести и длительности данного заболевания, эффективности предыдущего лечения, если оно проводилось, и появления рецидивов.
Нет смысла проводить консервативное лечение и ждать улучшения картины заболевания у животного в критическом состоянии, идя на поводу у его владельцев, стремящихся сохранить орган. Без воспаленного желчного пузыря животное прекрасно сможет жить. В то же время, если обстоятельства позволяют, можно и нужно проводить интенсивную медикаментозную терапию, во многих ситуациях – успешную.
Итак, если к нам обращается владелец кошки или собаки, у которой наблюдаются вышеперечисленные симптомы и при этом состояние животного удовлетворительное, отсутствует лихорадка, кахексия и безудержная рвота, анализы крови указывают на воспалительный процесс, а УЗИ выявляет необструктивный холецистит, возможно, с незначительным количеством желчного сладжа в полости, то мы осуществляем следующие действия:
- назначаем диету. Удобно для этого использовать промышленные корма при заболеваниях печени, так как в домашних условиях достаточно сложно приготовить механически и химически не раздражающую пищу.
- проводим адекватную антибиотикотерапию (предварительно взяв желчь для бакпосева). В случае, если посев окажется стерильным, – это будет отличной профилактикой вторичной инфекции. Бактериальный, в том числе эмфизематозный, холецистит требует долгосрочного применения антибиотиков:
амоксициллин/ампициллин (10-22 мг/кг каждые 8-12 часов, в/м) или препараты цефалоспоринового ряда (цефоперазон 50 мг/кг каждые 12 часов, в/в или в/м; цефалоспорины 4 -го поколения – цефкином (Кобактан, MSD AnimalHealth)- 0,5 мл/ 5 кг массы один раз в день в/м) и/или метронидазол (15-25 мг/кг каждые 12 часов, в/в) для грамположительной флоры и анаэробов (С.perfringens) на 14-21 день и фторхинолоны для грамотрицательных бактерий (E.coli и др.). Например, энрофлоксацин 5-20 мг/кг в день, п/к, на 10-14 дней.
По результатам антибиотикограммы после посева лечение необходимо корректировать. для улучшения свойств желчи и наилучшего ее отхождения мы назначаем урсодезоксихолевую кислоту (4-15 мг/кг в день, внутрь, лучше всего делить суточную дозу на два приема, в течение нескольких месяцев) и одестон (гимекромон). - при необходимости проводится терапия первичного или сопутствующего заболевания, инфузионная терапия, назначаются спазмолитические средства.
В том случае, если животное находится в критическом состоянии из-за остро развившегося холецистита, или мы имеем дело с рецидивирующим холециститом, или у нас есть все основания предполагать обструктивный холецистит и/или разрыв желчного пузыря и/или холедоха, проводим хирургическое лечение. Выбор метода хирургической коррекции зависит от предполагаемой патологии, возможностей клиники и опыта врача, проводящего манипуляцию. В последнее время холецистэктомия в нашей клинике проводится исключительно лапароскопически, что позволяет снизить травматичность операции, минимизировать осложнения и ускорить восстановительный период. При этом мы обязательно проводим контрастирование желчного пузыря, чтобы убедиться в проходимости желчных путей, и осуществляем промывание холедоха. К сожалению, ввиду анатомических особенностей у кошек и собак на сегодняшний день невозможно использовать эндоскопическую ретроградную холангиопанкреатографию для этих же целей, поэтому используем более инвазивные методы. Конечно, в ситуациях, связанных с разрывом желчного пузыря или обструкцией холедоха, мы прибегаем к классическому способу – лапаротомии. Вариантов операций на желчном пузыре несколько, и выбор хирурга определяется состоянием желчного пузыря, развившейся патологией и т. д. Но для этой темы требуется отдельная статья, поэтому здесь она будет опущена.
Перед проведением операции необходимо убедиться в отсутствии нарушений свертывающей системы крови. Этому могут способствовать длительный застой и нарушение оттока желчи (появляется дефицит витамина К, снижается уровень факторов коагуляции II, VII, IX и X). Поэтому проводят дополнительный анализ крови – коагулограмму. Для предотвращения возможной коагулопатии дополнительно вводят конакион (витамин К1) в дозе 1-2 мг/кг подкожно, этого достаточно для нормализации коагуляции в течение 3-12 часов после введения.
При сопутствующей желтухе у пациентов необходимо помнить об их предрасположенности к гипотонии в послеоперационном периоде и возможном развитии почечной недостаточности.
Ткани удаленного желчного пузыря обязательно отправляются в лабораторию для гистологического исследования.
Следует отметить, что до сих пор о проведении холедохотомии при обструктивных патологиях ведутся споры. Это опять же связано с особенностями анатомии наших пациентов, а точнее с малыми размерами структур билиарного тракта и большим числом описываемых осложнений (негерметичность швов, стенозы в послеоперационном периоде, высокая смертность при проведении подобных операций и др.). Опыт нашей клиники и сообщения S. G. Baker, P. D. Mayhew, S. J. Mehler (Journal of Small Animal Practice, Volume 52, Issue 1, pages 32-37, January 2011) позволяют говорить о низком уровне осложнений при данных операциях и требуют дальнейших разработок.
Прогноз заболевания условно благоприятный, при адекватно проведенном лечении функция желчного пузыря будет полностью сохранена. Наибольшую опасность могут представлять осложнения, связанные с разрывом желчного пузыря и возникновением перитонита. В случае его развития даже при адекватном лечении возможен летальный исход. Также необходимо уделять большое внимание наблюдениям лечащего врача, так как клиническая динамика имеет свои особенности в каждом конкретном случае.
Спонтанный пневмоторакс является относительно редким заболеванием у собак и кошек. Он возникает, когда воздух или газ попадают в плевральное пространство при отсутствии травматической или ятрогенной причины. Наиболее распространенным источником воздуха является поврежденная паренхима легкого. Однако другими источниками воздуха могут также являться трахея, бронхи, пищевод или развитие анаэробной инфекции в плевральной полости.
Спонтанный пневмоторакс классифицируется как первичный или вторичный на основании истории болезни, клинических признаков и возможности определения первопричины, исходя из полученных данных анамнеза и методов визуальной диагностики, таких как рентгенография грудной клетки, компьютерная томография (КТ) или торакоскопия.
Распространенными причинами спонтанного пневмоторакса у собак могут быть абсцессы легких, дирофиляриоз, неоплазия легких, буллезная болезнь паренхимы и плевры.
Согласно многим публикациям, наиболее частой причиной спонтанного пневмоторакса является буллезная болезнь.
Буллы – это скопления воздуха в слоях висцеральной плевры, чаще всего расположенных на верхушках или краях легких (фото 1). Они образуются, если воздух выходит из паренхимы легкого, перемещается к периферии доли и попадает в ловушку между слоями висцеральной плевры. В целом буллы выглядят как маленькие пузыри или волдыри на поверхности легкого, размер которых может достигать нескольких сантиметров. Другие варианты булл представляют собой заполненные воздухом пространства в паренхиме легких, которые возникают в результате разрушения, расширения и слияния смежных альвеол. Их размеры могут различаться, причем некоторые буллы могут быть незначительными (то есть включать несколько альвеол), а другие – очень большими (с вовлечением большей части легкого). Буллы ограничены перегородками соединительной ткани в легком и внутренним слоем висцеральной плевры.
Буллы подразделяются на три типа в зависимости от размера и связи с окружающей тканью легкого:
- Тип 1. Тонкие буллы, изнутри заполненные только воздухом и имеющие слабое соединение с легочной паренхимой. Они обычно находятся по краям легкого и имеют наружные стенки, которые могут быть выстланы мезотелиальными клетками на внешней поверхности.
- Тип 2. Буллы, возникающие из субплевральной паренхимы и плотно связанные с остальной частью легочной паренхимы эмфизематозного легкого. Внутренняя часть булл заполнена эмфизематозной тканью легкого, а наружные стенки образованы неповрежденной плеврой, выстланной мезотелиальными клетками.
- Тип 3. Буллы, которые могут быть очень большими и содержать эмфизематозную легочную ткань, распространяющуюся глубоко в легочную паренхиму.
Клинические признаки
Диагностика
Лечение
Стабилизация пациента имеет первостепенное значение, так как спонтанный пневмоторакс является угрожающим для жизни состоянием из-за снижения необходимой вентиляции легких.
Как правило, существует два варианта долгосрочного лечения (консервативное и хирургическое). Основная причина возникновения спонтанного пневмоторакса позволяет определить, какой из вариантов будет наиболее подходящим для пациента.
В гуманной медицине данная патология признана хронической болезнью легких. В ветеринарной практике эта информация не подтверждена в опубликованных источниках по причине малого количества исследований и публикаций. Но даже если не иметь в виду указанный факт, в случае принятия решения о выборе лечения очень сложно предположить вероятность рецидива из-за отсутствия единого подхода и протокола в лечении заболевания. Исходя из описанных данных, можно сделать вывод, что при принятии решения требуется индивидуальный подход.
В некоторых последних публикациях3, 8 отмечается, что пневмоторакс сохранялся у всех собак, несмотря на консервативное лечение, длящееся от 1 до 5 дней. Аналогичные результаты были также обнаружены в двух предыдущих исследованиях, где пневмоторакс сохранялся или рецидивировал у 8 из 11 (73%) и у 7 из 8 (88%) собак с подтвержденными буллами после лечения торакоцентезом или дренирования торакальным дренажом. Основываясь на этих данных, авторы статьи считают, что консервативное лечение не должно считаться надежным методом лечения пневмоторакса, вызванного буллезной эмфиземой.
Для собак, у которых хирургическое лечение не представляется возможным, длительное консервативное лечение может в конечном итоге разрешить пневмоторакс. Однако эта тактика должна быть согласована с владельцами животных по причине увеличения времени нахождения пациентов в стационаре и из-за вероятности возникновения потенциальных осложнений, связанных с проведением повторного торакоцентеза или с длительностью периода установки торакального дренажа. В конечном счете решение относительно продолжительности консервативного лечения должно основываться на степени тяжести клинических проявлений, скорости накопления воздуха, возможности исключения основного заболевания легких и проведения соответствующей хирургической операции, а также послеоперационного лечения.
Таким образом, по причине отсутствия единого протокола и подхода к лечению данной патологии зарубежные авторы рекомендуют хирургическое вмешательство в качестве более предпочтительного метода лечения спонтанного пневмоторакса. Эта рекомендация основана на более высоком общем уровне успешности данной методики в сравнении с консервативным лечением, более низком уровне рецидивов и более коротком времени нахождения пациентов в стационаре.
Хирургический подход включает резекцию легочных булл (фото 9) с частичной или полной лобэктомией пораженных долей легких. В настоящее время рекомендуется проводить срединную стернотомию, поскольку этот доступ позволяет тщательно осмотреть все интраторакальные структуры. Повреждения могут присутствовать на нескольких долях легких, поэтому каждая доля должна быть тщательно обследована. Буллы обычно визуализируются в форме очаговых полупрозрачных пузырчатых поражений на краях легких, хотя они могут располагаться в них где угодно. Размер, количество и расположение очагов на каждой доле определяют количество ткани легких, которое необходимо удалить. Для собак с повреждениями, связанными с несколькими долями, может оказаться невозможным удаление всех поражений без значительного снижения объема легких.
Собственные клинические наблюдения
Собака, сибирский хаски, 8 лет, сука. Содержание животного домашнее, спортивные нагрузки в анамнезе отсутствуют. За два дня до обращения в нашу клинику владельцы заметили у своего питомца одышку. До этого обращались в стороннюю клинику, где был сделан рентген и выявлен пневмоторакс, после чего с помощью торакоцентеза было аспирировано 500 мл свободного воздуха из грудной клетки. В день обращения в нашу клинику во время прогулки собака резко упала и начала синеть. Владельцы сразу обратились в клинику, находящуюся рядом, там отвели 3 л свободного воздуха слева и 1,5 л справа, затем пациент был экстренно направлен в нашу клинику для проведения дополнительной диагностики.
Клинический и биохимический анализы крови у животного оказались в пределах нормы.
Пациенту провели КТ, на которой были выявлены участки ателектаза каудального края краниальной доли и краниального края средней доли правого легкого, где определялся дефект паренхимы легкого, характерный для фрагментов спавшейся буллы. В момент проведения КТ пациенту был установлен торакальный дренаж для аспирации свободного воздуха. В течение двух последующих дней положительная динамика отсутствовала, свободный воздух продолжал набираться.
Было принято решение о проведении животному срединной стернотомии, в ходе которой была выявлена краевая булла (фото 9) краниальной доли правого легкого. Торакальный дренаж был извлечен через 2 дня. Пациент наблюдается 8 месяцев, рецидивов на сегодняшний день не отмечалось.
Собака, сибирский хаски, 3 года, кобель. Накануне приема в клинике владельцы заметили одышку у своего питомца, при этом он был активным, ночью спал спокойно, аппетит и жажда были в пределах нормы, рвота отсутствовала.
На рентгенограммах (фото 2) был обнаружен свободный воздух в плевральной полости. Пациенту провели КТ-обследование и выявили субплевральные буллы (фото 6, 7) краниальных долей легких.
После проведения КТ был установлен двусторонний торакальный дренаж и отведено более 2300 мл свободного воздуха. Владельцы животного, понимая все возможные осложнения и вероятность рецидивов, категорически отказались от оперативного вмешательства, в связи с этим их обучили, как пользоваться дренажами и отводить воздух. Дренажи были извлечены через 2,5 недели, пневмоторакс разрешился самостоятельно. Пациент наблюдается 7 месяцев, рецидивов на сегодняшний день не отмечалось.
Читайте также:

