Сколько групп крови существует у коровы
Опубликовано: 07.05.2024

Группа крови у животных – это индивидуальная антигенная особенность эритроцитов. Ее выявляют методом идентификации специфических групп углеводов и белков, которые входят в строение мембран эритроцитов. Данным образом происходит деление представителей различных биологических групп по особенностям крови.
При переливании крови разных групп вызывается несовместимость. При этом происходит взаимодействие агглютининов и агглютиногенов, склеивание эритроцитов и гемолиз. Из-за этого перед переливанием животным проводят тест, определяющий группу крови: выявляется совместимость донора и реципиента.

Сколько групп крови у разных животных
Учеными давно установлено, что группы крови у животных разные, причем, у различных представителей их количество существенно варьируется. Так, у собак выделяют 11 групп, у кошек – три, у лошадей – 8, у кур – 60, у свиней – 30. Самыми изученными являются группы крови домашних и сельскохозяйственных животных. В ветеринарии, данные о группе крови у животных помогают в селекционировании, установлении отцовства, для структурирования породы, а также для проверки животных при экспорте и импорте.
Особенности крови собак
Группы крови у животных отличается от человеческих. У собак выделяют одиннадцать основных групп, которые различаются между собой составом белков и антигенов. Группы крови собак обозначаются цифрами и латинскими буквами A, Tr, B, C, D, F, J, K, L, M, N. У большинства собак выявляется первая группа крови.

Переливание крови собакам
Задаваясь вопросом, а есть ли у животных группа крови, многие даже не задумываются, что у них так же, как у человека, присутствует целая система деления крови по группам. Так, у собак существует междуврачебная система обозначения DEA, в которой выделяют шесть групп:
- DEA1.1 – это универсальная группа.
- DEA1.2.
- DEA3.
- DEA4 - также считается универсальной, которая подходит всем собакам.
- DEA 5.
- DEA 7.
Как и у человека, даже при переливании универсальной группы, у собак проводят тест на совместимость.
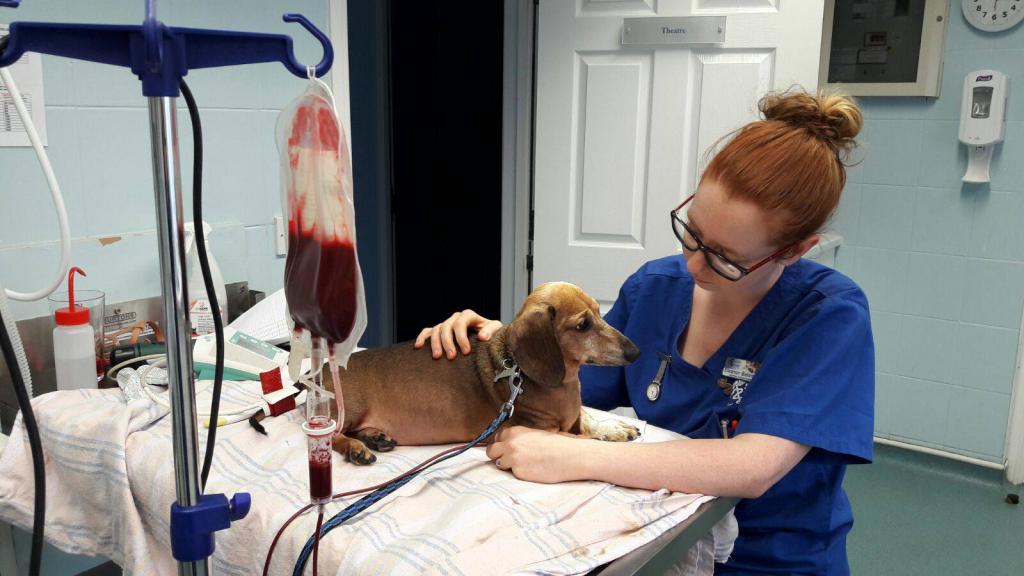
Самая универсальная группа у собак
Одной из самых важных считается кровь DEA1.1. Сведения о группе обязательно включаются в ветпаспорт.
Группы крови животных и человека разные, но обе характеризуются резус-фактором. У животных он так же может быть положительным и отрицательным. Причем, половина животных имеют DEA1.1 +. Таким собакам можно переливать кровь любой породы, но только с такой же кровью. Те животные, у которых DEA1.1 –, считаются универсальными донорами.
При первом переливания кровь собак с группой DEA1.1+ можно перелить животным, которых кровь DEA1.1 –. Первое переливание проходит успешно. После него в организме накапливают антитела и при повторном переливании, возникает иммунная реакция с тяжелыми последствиями.
Перед переливанием крови любой группы обязательно проводят тест на совместимость, во время которого проверяют наличие антигенов.
Кровь у собак не имеет связанных с породами различий. Так, кровь от спаниеля можно переливать мопсу, терьеру и другим породам, главное, чтобы она была совместима.

Особенности крови кошек
Любители кошек могут столкнуться с проблемой, когда животному необходимо сделать переливание. В такие моменты возникает вопрос, какие группы крови у животных существуют и как они совместимы?
Существует целая система групп крови у кошек под общим названием АВ. Чаще всего у кошек встречается группа А, а вот В встречается реже. Исключительно редко встречаются кошки с группой АВ: они считаются универсальными реципиентами.
Перед переливанием крови кошкам также проводят тест на совместимость. Это связано с тем, что кровь кошки-донора и реципиента могут не совпадать, содержать антигены, из-за которых происходит слипание и разрушение эритроцитов.
Влияние группы крови на разведение кошек
Для получения здорового потомства, заводчики должны отказаться от спаривания кошек с группой В и котов с группой А, а вот кошек с кровью группы А можно вязать с любыми котами.
При получении потомства от кошек или котов с группой В будут котята с аналогичной кровью. Таким образом, будет создан своеобразный «остров», в котором будут все животные с одинаковой кровью. Чтобы получить помет, кошки должны будут опять же спариваться с котами, кровь которых имеет группу В. Из-за этой особенности, спарить кошку с котом с другой кровью, не получится, так как это опасно для потомства: оно будет рождаться мертвым или же умирать в первые часы жизни.
Иногда бывает так, что для определенной породы характерна группа В. В таких случаях для получения здорового потомства используют представителей только данной породы. Если же кошка с группой В ожидает потомство от кота с кровью А, то при рождении всем котятам делают тест на группу крови. Всех особей с группой А убирают от кошки и выкармливают отдельно.
Группы крови у с/х животных
У людей группа крови определяется системой АВО и резус-фактором. Примерно у 80% населения Земли он положительный, а у остальных – отрицательный. Если у супружеской пары муж с положительным резусом, а жена с отрицательным, то велика вероятность рождения детей с положительным резус-фактором. В этом случае у матери в организме формируются антитела, которые проникают через плаценту в кровь эмбриона и разрушают его эритроциты. У животных антитела не проникают через плаценту, а накапливаются в молозиве. После появления потомства, они попадают в организм животных с первой дозой, вызывая разрушение эритроцитов и гибель потомства. Из-за этой особенности, при племенном разведении, определяют не только группы крови сельскохозяйственных животных и их потомства, но и резус-фактор. Подобное обследование проводят у свиней, лошадей, коров и других с/х животных. В случае обнаружения конфликтных ситуаций, новорожденных животных отнимают от матерей и выкармливают искусственно.
Роль групп крови в животноводстве
Использование групп крови в происхождении линий и пород
Весьма перспективно применение групп крови при анализе происхождения отдельных стад, линий и целых пород скота. Исследования Л. Рендела (1958) и других ученых выявили значительные межпородные различия в группах крови крупного рогатого скота. Поскольку факторы крови (антигены) стойко передаются от родителей к потомкам, изучение групп крови должно сыграть в племенном деле важную роль, помогая установить происхождение пород и отдельных групп животных и взаимоотношения между ними. Так, после анализа групп крови у чешского красно-пестрого скота И. Матоушек пришел к выводу, что в образовании этого скота участвовали многие породы. И. Р. Гиллер (1970) в результате изучения групп крови у симментальского скота в племенных заводах "Тростянец" и "Терезино" выявил довольно значительные различия между этими стадами по распространенности некоторых аллелей системы В. Чрезвычайно интересной является идея о возможности связи наследования групп крови и других полиморфных признаков с наследованием продуктивных свойств животных, например жирномолочности. Правда, гены, контролирующие наследование групп крови, по-видимому, не оказывают прямого влияния на развитие тех или иных признаков продуктивности. Но эти гены могут находиться в одних и тех же хромосомах с генами, определяющими продуктивность животных. В этом случае те или иные группы крови могут служить "генетическими маркерами", сигнализирующими о наличии у данного животного генов высокой жирномолочности или других генов, непосредственно связанных с продуктивными свойствами животных. Поскольку группы крови можно определить сразу же после рождения животного, то можно предполагать, что по ним смогут предсказывать его будущую продуктивность. Успешное решение этого вопроса привело бы к "революции" в племенной работе. Имеется довольно много сообщений о связи между отдельными группами крови (а также другими полиморфными признаками) и некоторыми признаками продуктивности животных. Однако далеко не всегда опубликованные данные потверждаются при повторении исследований в других стадах и группах животных. Весьма обнадеживающими являются исследования И. Р. Гиллера (1970), который определил группы крови знаменитой коровы Воротки 5992 (племенной завод "Тростянец"), уникальной по жирности молока (6,04%). Оказалось, что потомки. Воротки, унаследовавшие от нее высокую жирномолочность, одновременно унаследовали и аллель OiTG'K' системы В. Те же потомки Воротки, у которых этот аллель отсутствовал, не имели и столь высокой жирномолочности. Конечно, эти данные еще требуют проверки на других животных, но они, во всяком случае, вселяют надежду на успешное разрешение данной проблемы. На основании приведенного исследования значительно повысилась вероятность устанавливать генетическое сходство между родителями и детьми не статистическими приемами ("доли крови", генетическое сходство по формуле С. Райта), а по проценту повторений группы крови родителя у потомка. Такое генетическое сходство не между группами с большой численностью животных, а между индивидуумами было бы очень ценным при работе с линиями и семействами племенных животных для анализа сочетаемости, кроссов и скрещивания.
Тестирование групп крови
Первые иммуногенетические исследования сельскохозяйственных животных были осуществлены Эрлихом и Монгенротом в 1900 г., обнаружившими индивидуальные особенности крови коз; значительный прогресс в этой области был достигнут в 40-50 годах нашего столетия, когда впервые были получены антитела к ряду антигенов эритроцитов.
Антигены расположены на поверхности эритроцитов и имеют строго определенную пространственную структуру; по химической природе это гликопротеиды и гликолипиды.
У крупного рогатого скота на сегодняшний день выявлено свыше 80 антигенных факторов, составляющих 12 систем групп крови. При таком количестве антигенных факторов возможно бесчисленное множество их сочетаний, поэтому исключается существование животных, имеющих одинаковый тип крови. Набор антигенных факторов на поверхности эритроцитов индивидуален для каждого животного и в течение жизни не меняется. Антигенные факторы передаются по наследству, поэтому у потомков могут быть только те антигены, которые есть у его родителей. Установлено, что ряд антигенов наследуется независимо друг от друга, а часть антигенов образуют группы сцепления. Двенадцать систем групп крови контролируются 12 локусами разных хромосом. В пределах каждой системы, - группы крови наследуются как простые признаки. В каждом локусе представлены два аллеля: один от отца, - второй от матери, которые наследуются кодоминантно. Кодоминантность — (от лат. со с, вместе и доминантность), участие обоих аллелей в определении признака у гетерозиготной особи.
При определении достоверности происхождения потомства принят следующий порядок оформления данных анализа: в бланк "типы крови КРС", сначала вписывают тип крови отца, строкой ниже - матери, следом тип крови потомка. Чтобы определить генотип потомка необходимо установить аллели, унаследованные потомком от отца и матери по всем генетическим системам групп крови.
Определение достоверности происхождения потомства основано на принципе исключения, т.е. потомок не должен иметь факторов крови отсутствующих у его родителей. Если у потомка выявляются аллели, отсутствующие у родителей в одной или нескольких системах, отрицается достоверность его происхождения. Отцовство отрицается, если у потомка обнаруживаются аллели, отсутствующие у отца, материнство - если отсутствуют одна или несколько материнских аллелей (феногрупп). Животных, достоверность которых не подтвердилась в ходе анализа исключают из числа племенных.
Практическая реализация иммуногенетического мониторинга в племенном молочном скотоводстве
Иммуногенетика открывает возможности управления селекционным процессом на основе генетических маркеров. Рассмотрим некоторые аспекты практической реализации иммуногенетического мониторинга в племенном молочном скотоводстве.
Чистопородное разведение:
- характеристика генофонда и генетической структуры стада или породы;
- определение достоверности происхождения потомков;
- определение селекционной и генетической дифференциации групп животных;
- определение коэффициента генетического сходства линий;
- ранний прогноз возникновения инбредной депрессии;
- подбор родительских пар на основе генетических маркеров.
Межпородное скрещивание:
- прогнозирование гетерозисного эффекта;
- определение генетического расстояния между породами;
- определение в каждом конкретном случае истинных помесей и генетический возврат к исходным родительским породам при разведении помесей "в себе";
- определение истинной степени кровности, т.е. долю участия генотипов каждого из родителей в потомке в каждом конкретном случае.
Использование групп крови в борьбе с различными наследственными заболеваниями
В последние годы несколько принижена роль иммуногенетики, и в частности, групп крови, но это пока единственные генетические маркеры, которые широко используются и, видимо, еще долгие годы будут использоваться в селекционной практике. Одна из наиболее плодотворных сфер приложения данных иммуногенетики в животноводстве – контроль достоверности происхождения племенных животных. В настоящее время во всех странах мира в с развитым животноводством введена обязательная проверка достоверности происхождения племенных животных по генетическим маркерам крови. Эффективность установления достоверности происхождения по группам крови зависит от числа реагентов, чем их больше, тем процент достоверности выше. В США эффективность установления достоверности происхождения по группам крови составляет 98%. В Германии, Франции, Финляндии, Дании, Швеции, Норвегии и др. странах эффективность установления достоверности происхождения – 95-97%.
При типировании животных по группам крови после семейного анализа определяем у них генотип, который позволяет не только устанавливать происхождение потомков, но и следить за направленностью селекционных процессов в популяции. Группы крови в организме не являются нейтральными, а вовлечены во многие физиологические процессы, в том числе связаны и с генами, контролирующими хозяйственно-полезные признаки. Эти связи обусловлены сцеплением, локусы групп крови в результате внутрихромосомных перестроек входят в ассоциацию селекционируемых генов, адекватно отражая все происходящие в популяции изменения. Например, у крупного рогатого скота М-локус групп крови сцеплен с группой генов, контролирующих молочную продуктивность. В настоящее время почти все известные локусы групп крови крупного рогатого скота картированы. Картирование – определение локуса для специфического биологического признака. Все они расположены на разных хромосомах в сцепленных группах локусов, каждая их которых контролирует в организме определенные жизненно важные признаки. Что касается перспектив использования групп крови в селекции животных на повышение устойчивости к заболеваниям, то результаты исследований показывают , что группы крови тоже связаны со многими заболеваниями. В частности, у крупного рогатого скота установлено сцепление Bola-комплекса с М-системой групп крови. Ген М’ М –локуса групп крови находится в блоке генов Bola-комплекс, контролирующих чувствительность к маститам.
В России рост заболеваемости превышает рост продуктивности. Бичом являются лейкоз, мастит, гинекологические заболевания. Селекционным методом оздоровить популяцию нельзя, так как наследуемость устойчивости к заболеваниям очень низкая. С помощью генетического маркера, ассоциированного с определенным заболеванием, можно повысить устойчивость только к данному заболеванию, для чего из стада необходимо выбраковать 20-25% животных с геном предраположенности к данному заболеванию. К другим заболеваниям животные будут восприимчивы.
Иммуногенетический контроль как метод повышения эффективности племенного учета
Иммуногенетика — молодой раздел науки о наследственности и изменчивости животных. Большинство иммуногенетических лабораторий проводят исследования, направленные на производство реагентов, их идентификацию, открытие и определение принадлежности новых антигенов к генетическим системам, изучение их специфики, закономерностей синтеза антител против разных антигенов.
Группы крови животных определяют путем постановки реакций гемолиза эритроцитов проверяемых образцов с моноспецифическими сыворотками-реагентами, которые выявляют соответствующие эритроцитарные антигены. Производство реагентов — сложный процесс, связанный с изоиммунизацией и анализом выработанных антител. Полученные в иммуногенетических лабораториях антигены проходят специальную проверку в сравнительных испытаниях, которые систематически проводит Международное общество по изучению групп крови животных. Благодаря идентификации реагентов результаты тестирования всех лабораторий отличаются лишь набором использованных реагентов.
Совокупность комбинаций разных генетических систем создает строго индивидуальный тип крови. Это обеспечивает дифференциацию всех особей в пределах популяции, стада, линии и позволяет идентифицировать каждую из них.
Доказано строгое наследование группы крови. Животное может иметь только тот антиген, который был хотя бы у одного из родителей. В свою очередь оно способно передать потомству антигены, содержащиеся в его эритроцитах. Набор антигенов не изменяется в течение всего периода постэмбрионального развития. Это имеет большое значение, так как дает возможность установить соответствие характеристик животного данным племенного свидетельства.
Методика проверки достоверности происхождения предусматривает генетический анализ групп крови животного и его родителей. При этом учитывают, что в каждом локусе группы крови потомок наследует один аллель от отца, другой — от матери, поэтому у него не может быть группы крови, которой не имел ни один из родителей.
В нашей стране первые проверки соответствия записей о происхождении результатам иммуногенетического анализа провел П.Ф. Сороков, который определил неправильную регистрацию данных у четверти изученных животных.
Основные причины ошибок в племенном свидетельстве — недосмотр обслуживающего персонала и биологические особенности размножения животных. Чаще всего неточности в родословной появляются из-за путаницы при получении, расфасовке, криоконсервации и хранении спермы или ее подмены при осеменении. Бывает, что путают и телят из-за зарастания ушного номера или потери метки, ошибочной записи в журнале регистрации приплода. При повторном осеменении спермой других быков менее чем через 21 день после первого, когда точно установить отца невозможно, им считают быка, семя которого использовали при втором осеменении.
Задача иммуногенетического контроля заключается не только в том, чтобы зафиксировать ошибки в записях о происхождении, он должен еще и способствовать налаживанию племенного учета.
Эритроциты животных содержат антигены клеточной поверхности, которые подвергаются полиморфизму и дают начало группам крови . Антигены из системы групп крови человека АВО также обнаружены у обезьян и обезьян Старого Света , и эти типы восходят к происхождению гуманоидов. Кровь других животных иногда агглютинирует (с различной степенью интенсивности) с реагентами группы крови человека , но структура антигенов группы крови у животных не всегда идентична той, которая обычно встречается у людей. Поэтому для классификации большинства групп крови животных используются системы определения группы крови, отличные от систем, используемых для классификации крови человека.
СОДЕРЖАНИЕ
- 1 группы крови обезьян
- 1.1 Группа крови резус
- 1.2 Системы групп крови шимпанзе и обезьян Старого Света
- 2 группы крови собак
- 3 группы крови кошек
- 4 группы крови лошадей
- 5 групп крови крупного рогатого скота
- 6 Ссылки
- 7 Дальнейшее чтение
- 8 Внешние ссылки
Обезьяньи группы крови
У человекообразных обезьян и обезьян были обнаружены две категории групп крови, человеческий тип и обезьяний, и они могут быть проверены с помощью методов, установленных для группирования человеческой крови. Имеются данные о группах крови обычных шимпанзе , бабуинов и макак .
Резус-группа крови
Система резус названа в честь макаки - резуса , после экспериментов Карла Ландштайнером и А. С. Винер , который показал , что кролик, при иммунизации макак - резусов эритроцитов, производить антитела , которые также агглютинирует в эритроциты многих людей.
Системы групп крови шимпанзе и обезьян Старого Света
Две сложные системы групп крови шимпанзе, системы VABD и RCEF, оказались аналогами систем групп крови человека MNS и Rh соответственно. У обезьян Старого Света были определены две системы групп крови : система Drh у макак и система Bp у бабуинов, обе связаны по крайней мере одним видом, разделяемым любой из систем групп крови.
Группы крови собак
Описано более 13 групп крови собак . Восемь типов DEA (антиген эритроцитов собаки) признаны международными стандартами. Из этих типов DEA DEA 4 и DEA 6 появляются в красных кровяных тельцах
98% собак. Таким образом, собаки с DEA 4 или DEA 6 могут служить донорами крови для большей части собачьей популяции. Любой из этих типов DEA может стимулировать иммунный ответ у реципиента переливания крови, но реакции на DEA 1.1+ являются наиболее серьезными.
Собаки с положительным результатом DEA 1.1 (от 33 до 45% популяции) являются универсальными реципиентами, то есть они могут получать кровь любого типа, не ожидая опасной для жизни гемолитической реакции при переливании крови. Собаки с отрицательным результатом DEA 1.1 являются универсальными донорами. Кровь от собак с положительной реакцией на DEA 1.1 никогда не следует переливать собакам с отрицательной реакцией на DEA 1.1. Если это первое переливание крови собаке, перелитые эритроциты будут иметь сокращенный срок жизни из-за образования аллоантител к самим клеткам, и животное навсегда останется сенсибилизированным к крови с положительным результатом DEA 1.1. Если это второе такое переливание, в течение нескольких часов последуют опасные для жизни состояния. Кроме того, эти аллоантитела будут присутствовать в молоке суки (молозиве) и отрицательно повлиять на здоровье щенков с отрицательным DEA 1.1.
Помимо групп крови DEA, Дал - еще одна группа крови, широко известная у собак.
Группы крови кошек
Большинство кошачьих групп крови входят в группу крови AB, которая обозначает кошек как A, B или AB. Этот тип определяется аллелями CMAH, которыми обладает кошка. Большинство аллелей A, по-видимому, преобладает над рецессивным типом B, который чаще встречается в некоторых странах, кроме США. Тип «AB», по-видимому, выражается третьим рецессивным аллелем. В исследовании, проведенном в Англии, 87,1% беспородных кошек относились к типу A, в то время как только 54,6% племенных кошек относились к типу A. Кошки типов A и B имеют естественные аллоантитела к противоположной группе крови, хотя реакция типа B кошки к крови типа А более серьезны, чем наоборот. Исходя из этого, все кошки должны пройти простой анализ крови, чтобы определить их группу крови перед переливанием крови или разведением, чтобы избежать гемолитической болезни (или неонатального изоэритролиза ). Также важно проверить кошек-доноров на наличие FeLV / FIV .
Дополнительная система группы крови - Mik (+/-). Он был идентифицирован только в 2007 году, а конкретный ген еще не картирован, но распространенность Mik- кажется достаточно высокой, чтобы вызывать опасения.
Группы крови лошадей
У лошадей восемь групп крови, из которых семь, A, C, D, K, P, Q и U, признаны во всем мире, а восьмая, T, в основном используется в исследованиях. Каждая группа крови имеет как минимум два аллельных фактора (например, группа крови A имеет a, b, c, d, e, f и g), которые можно комбинировать во всех комбинациях (Aa, Afg, Abedg и т. Д.) ), чтобы получить много разных аллелей. Это означает, что лошади могут иметь около 400 000 комбинаций аллелей, что позволяет использовать анализ крови в качестве точного метода идентификации лошади или определения отцовства. В отличие от людей лошади естественным образом не вырабатывают антител против антигенов эритроцитов, которых у них нет; это происходит только в том случае, если они каким-то образом подвергаются воздействию другой группы крови, например, при переливании крови трансплацентарного кровотечения во время родов.
При вязке кобылы с жеребцом с другой группой крови, обычно с кровью Aa или Qa, существует риск неонатального изоэритролиза, если жеребенок наследует группу крови жеребца. Группа C также вызывает определенное беспокойство. Это также может произойти, если кобыла связана с домкратом из-за «ослиного фактора». Это иммуноопосредованное заболевание опасно для жизни и часто требует переливания крови.
В идеале перед переливанием следует провести перекрестное сопоставление или можно использовать универсального донора. Идеальный универсальный донор цельной крови - это беспородный мерин с отрицательными Aa, Ca и Qa. Если это недоступно, мерин, предпочтительно той же породы, что и пациент, может использоваться в качестве донора, а перекрестное сопоставление может быть грубо доступно путем смешивания донорской сыворотки с кровью пациента. Если смесь агглютинирует , донорская кровь содержит антитела против крови пациента, и ее не следует использовать.
Группы крови крупного рогатого скота
Полиморфные системы крупного рогатого скота включают полиморфизмы A, B, C, F, J, L, M, S и Z.

CC BY
Аннотация научной статьи по животноводству и молочному делу, автор научной работы — Романов Ю.Д., Кольцов Д.Н., Гонтов М.Е., Чернушенко В.К.
Исследования проведены на 85 быках-производителях сычевской породы, включающих в свои цепные родословные 466 предков и 128 коров-рекордисток и включающих в свои цепные родословные 821 предка. Цель показать возможность использования аллелей групп крови для маркировки линий и семейств и выяснить причины прерывания цепных родословных у животных. Продолжительность цепных родословных быков-производителей составила в среднем 4,44 поколения, а коров-рекордисток в среднем 3,16 поколения. Основная причина снижения длины маркированных родословных использование в селекции животных с неправильным происхождением. Предложена простая формула для оценки «препотентности» быков-производителей и родоначальниц семейств при анализе их происхождения с учетом использования генетических маркеров .
Похожие темы научных работ по животноводству и молочному делу , автор научной работы — Романов Ю.Д., Кольцов Д.Н., Гонтов М.Е., Чернушенко В.К.
Текст научной работы на тему «Использование систем в и с групп крови при анализе происхождения крупного рогатого скота»
дователями доказано, что от более крупных животных получают крупный развитый приплод, больше мяса и другие продукты.
Нами проведено индивидуальное взвешивание опытных и контрольных телят. Данные живой массы животных приведены в таблице 2.
Таблица 2 - Живая масса подопытного молодняка
Опытная, п=18 Контрольная, п=11
Живая масса: при рождении, кг, М+m 33,4+0,45 28,2+0,56
в 3-мес. возрасте, кг, М+m 134,7+1,38 122,2+1,47
При рождении средняя живая масса экспериментальных животных составила 33,1кг; в контроле - 28,2 кг, или на 4,9 кг была выше в опыте. В последующие изучаемые возрастные периоды выращивания более высокая живая масса отмечена также у телок опытной группы, которая превышала показатели своих сверстниц в контрольной группе в 3-месячном возрасте на 12,5 кг.
Оплодотворяемость коров от замороженного сексированного семени в опытной группе составляла 72%, или из осемененных 25 голов повторно пришли в охоту 7 голов, или 28,0%. В то же время от обычной семени оплодотворяемость в среднем составляла 84%, или перегуляли 16%. В опытной группе отелилось 18 коров, сто процентов рождались телочки, а в контроле отелилась 21 гол., в том числе 11 телочек и 10 бычков.
Сравнивая первую и вторую группы, установили, что телочки второй группы значительно уступали первой опытной группе по показателям живой массы в возрасте 3 месяцев.
1. Черняк Н., Сексированное семя - инновация в молочном скотоводстве на этапе управления воспроизводства стада / Н. Черняк, О. Гончарук /Молоко и ферма, 2012
2. Дунин, М.И. Использование разделенного по полу семени в практике животноводства. /Ерохин А.С., Дунин М.И.// Сельскохозяйственная биология.- 2009
3. Интернет ресурс // www.cogentuk.com.
4. Селионова М.И., Айбазов А.М.М. Геномные технологии в селекции сельскохозяйственных животных//Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. 2014. Т. 1. № 7 (1). С. 140-145.
5. Мамонтова Т.В., Айбазов А.М., Русакова О.С. Современные тенденции развития мирового и российского рынка биотехнологий в животноводстве// Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. 2014. Т. 2. № 7. С. 292-300.
УДК 636.082.2 UDC 636.082.2
ИСПОЛЬЗОВАНИЕ СИСТЕМ В И USING B AND C SYSTEMS OF
С ГРУПП КРОВИ ПРИ АНАЛИЗЕ BLOOD GROUPS IN THE ANALY-SIS
ПРОИСХОЖДЕНИЯ КРУПНОГО OF THE CATTLE ORIGIN РОГАТОГО СКОТА
Ю.Д. Романов, канд. с.-х. наук, Romanov J.D.,
Д.Н. Кольцов, канд. с.-х. наук, Koltsov D.N.,
М.Е. Гонтов, канд. с.-х. наук, Gontov M.E.,
В.К. Чернушенко, доктор с.-х. наук Chernushenko V.K.
ФГБНУ Смоленский НИИСХ SMNIISH
koltsovdm@yandex.ru Исследования проведены на 85 бы- The studies are conducted on 85 sires ках-производителях сычевской по- of Sychevska breed that include in their
роды, включающих в свои цепные chain of ancestors genealogical 466 родословные 466 предков и 128 ко- ancestors and 128 top performer cows
ров-рекордисток и включающих в comprising in their chain 821
свои цепные родословные 821 пред- genealogical ancestors. The aim was ка. Цель - показать возможность ис- the possibility of blood group alleles пользования аллелей групп крови using for the marking of lines and для маркировки линий и семейств families, and also to find out the reasons и выяснить причины прерывания for interruption of the chain pedigrees цепных родословных у животных. in animals. The duration of the chain Продолжительность цепных родос- pedigrees in sires averaged 4.44 ловных быков-производителей со- generations, in top performer cows it ставила в среднем 4,44 поколения, was in an average of 3.16 generations. а коров-рекордисток в среднем 3,16 The main reason of reduction in length поколения. Основная причина сни- of marked pedigrees is the use in the жения длины маркированных родос- breeding of animals with the wrong ловных - использование в селекции origin. A simple expression is proposed животных с неправильным проис- for the evaluation of «hereditary хождением. Предложена простая capacity» in sires and ancestors of формула для оценки «препотентно- families in the analysis of their origin сти» быков-производителей и родо- with the use of genetic markers. начальниц семейств при анализе их происхождения с учетом использования генетических маркеров.
Ключевые слова: генетические мар- Key words: genetic markers, blood керы, группы крови, структурные ро- groups, structural genealogies, sires, дословные, быки-производители, ко- top performer cows ровы-рекордистки
Животноводство является одной из важнейших отраслей сельского хозяйства, обеспечивающих человечество продуктами, которые служат источником пополнения организма человека полноценными белками и многими другими необходимыми питательными веществами [6, 7, 8, 12].
Оценка животных по происхождению предполагает, что от более ценных по своим качествам родителей будет получено и лучшее потомство [11, 13]. Знаменитый афоризм Щепкина М.М. «без знания кровей нет племенного дела» [15] более всего применим к индивидуальному подбору, где наряду с учетом индивидуальных особенностей родительских пар учитывают благоприятную сочетаемость предков родителей, что можно сделать только на основании знания родословных [14].
Линейное разведение и разведение по семействам предполагают передачу ценных наследственных качеств родоначальника или родоначальницы своим потомкам в ряду последующих поколений [4]. Современная зоотехническая наука располагает многочисленными методами маркировки генотипа животного: генотипы различных полиморфных белков и ферментов сыворотки крови, эритроцитарные антигены групп крови [5], микросателлитные последовательности ДНК, маркеры однонукле-отидного полиморфизма (SNP), представляющие точечные мутации в последовательности ДНК [1, 3].
Цель работы - показать возможность использования генетических маркеров аллелей групп крови ЕАВ- и ЕАС- систем для маркировки линий и семейств и выяснить причины прерывания цепных родословных у исследованных животных.
Исследования проведены на 85 быках-производителях сычевской породы, включающих в свои цепные родословные 466 предков и 128 коров-рекордисток, имевших удой свыше 6000 кг молока за 305 дней наивысшей лактации и включающих в свои цепные родословные 821 предка. Анализ родословных проводили на базе ОАО
племзавод «Рассвет» Новодугинского района Смоленской области. Все коровы и быки-производители, принадлежащие ОАО «Смоленское» по племенной работе на протяжении 35 лет, тестировались по эритроцитарным факторам 12-ти генетических систем групп крови (A, B, C, F-V, J, L, M, S, Z, N', T', R') сначала в лаборатории ВИЖа, затем использовались собственные реагенты, полученные в лаборатории биотехнологии Смоленского НИИСХ.
Продолжительность цепных родословных быков-производителей составила в среднем 4,44 поколения в период с 1952 по 2002 годы, коров-рекордисток в среднем 3,16 поколения за период с 1960 по 2005 годы. При анализе структурных родословных у производителей по группам крови установлено 60 случаев неправильного происхождения со стороны женских и 6 - со стороны мужских из общего числа предков, участвовавших в построении родословных. У коров соответственно 69 и 4 случая неправильного происхождения из общего количества предков. В родословных быков участвовало 120 матерей - рекордисток с продуктивностью свыше 6000 кг молока за наивысшую лактацию, в родословных коров - 221 животное с рекордной продуктивностью.
Установлены четыре причины снижения длины маркированных родословных коров-рекордисток и быков-производителей: использование в селекции животных с неправильным происхождением, установленным по группам крови; раннее выбытие животных по разным основаниям; сбой по наследованию аллелей и человеческий фактор. При анализе происхождения быков-производителей и родоначальниц семейств с учетом использования генетических маркеров для оценки их «препотент-ности» нами разработана следующая формула:
где: ПП - препотентность животного по происхождению,%; ВМ - возможное число поколений с маркерами в цепной родословной; ФМ - фактическое число поколений с установленным генетическим маркером в цепной родословной.
Например, производитель Уголек 6754 имеет генотип по ЕАВ-локусу I1Y2I''B1I1O2 с маркерным аллелем родоначальника линии Леванта 5091 I1Y2I/. Левант на протяжении двух поколений передавал предкам Уголька другой аллель из ЕАВ-локуса, а именно I1Y2G'G'/. Затем в результате целенаправленного подбора маркерный аллель родоначальника был восстановлен и в дальнейшем передавался без сбоя. Следовательно, используя указанную формулу, «препотентность» быка Уголек 6754 по схожести с родоначальником линии составит соответственно: ПП=4'6*100=66,7 %. Аналогичную схему расчетов можно провести и по семействам. В четвертом поколении корова Жданка 618 (3-7177-3,68) имела генотип по ЕАВ-локусу BGKO'/I'Q' с маркерным аллелем родоначальницы Арены 174 (12-6548-3,98) I'Q'. В пятом поколении произошел «сбой», и ее дочь Жимолость 2221 (3-6443-3,66) унаследовала второй аллель матери BGKO', который пришел к Жданке 618 от отца быка Высотного 6333. Из пяти тестированных поколений маркер родоначальницы семейства из ЕАВ-локуса групп крови I'Q' встретился в четырех поколениях. Следовательно, «препотентность» коровы Жданки 618 по схожести с родоначальницей семейства Ареной составит 80 %. Использование при анализе происхождения животных маркеров ЕАС-локуса групп крови и применение при расчетах предлагаемой формулы приводит к схожим результатам, согласуемым с другими авторами [2, 16].
В рамках импортозамещения необходимо продолжить использование в системе традиционной селекции крупного рогатого скота оценку быков-производителей и коров по происхождению с учетом маркирования линий и семейств аллелями групп
крови ЕАВ- и ЕАС-локусов. Данный вывод, с нашей точки зрения, подтверждает мнение А.М. Машурова (1980) «Руководствуясь выявленными закономерностями внутренней организации популяций, можно заключить, что основой всестороннего улучшения и регуляции их генетической структуры является научно обоснованная система использования линейных животных-улучшателей, характеризующихся консолидированной наследственностью, выявленной с использованием маркерных генов» [9].
1. Введение в ДНК-технологию/ В. И. Глазко [и др.]. - М.: Росинформагротех, 2001. - 436 с.
2. Дубинин, Н. П. Аллельные маркеры при наследовании отдельных участков и целых хромосом у сельскохозяйственных животных/ Н. П. Дубинин, А. М. Машуров// Сельскохозяйственная биология. - 1986. - № 2. -с. 71-79.
3. Кент Вайгел Селекция по геному. Освещение с точки зрения практики/ Вайгел Кент. - CRI International Horizons, 2008. - режим доступа: http://www.mkg-nn.ru/kb-pages/genom02html дата обращения: 28.04.2016.
4. Кононенко, С. И. Полиморфизм гена H-FABR и его роль в формировании продуктивности свиней разных пород / С. И. Кононенко, А. Р Каграманов // Труды Кубанского государственного аграрного университета. -2011. - Т. 1. - № 29. - С. 151-154.
5. Кононенко, С. И. Влияние гена эстрогенового рецептора на воспроизводительные качества свиней разных пород / С. И. Кононенко, В. В. Семенов, Л. Н. Чижова, Н. Г. Марутянц, А. Р. Каграманов // Труды Кубанского государственного аграрного университета. - 2011. - Т. 1. - № 29. - С. 135-137.
6. Кононенко, С. И. Биолого-продуктивный потенциал лактирующих коров при скармливании антиоксидан-тов / С. И. Кононенко, Р. Б. Темираев, А. А. Газдаров //Труды Кубанского государственного аграрного университета. - 2011. - № 32. - С. 163-165.
7. Кононенко, С. И. Высокоэффективный способ повышения продуктивности / С. И. Кононенко //Известия Горского государственного аграрного университета. - 2016. - Т. 53. - № -1. С. 67-70.
8. Кононенко, С. И. Актуальные проблемы организации кормления в современных условиях /С. И. Кононен-ко // Политематический сетевой электронный научный журнал Кубанского государственного аграрного университета. - 2016. - № 115. - С. 951-980. - Режим доступа: http://ej.kubagro.ru/2016/01/pdf/60.pdf
9. Кравченко, Н. А. Разведение сельскохозяйственных животных/ Н. А. Кравченко. - М.: Изд-во с. - х. литературы, журналов и плакатов, 1973. - 487 с.
10. Машуров, А. М. Генетические маркеры в селекции животных/ А. М. Машуров. - М.: Наука, 1980. - 318 с.
11. Реконструкция генотипов групп крови у племенных животных сычевской породы крупного рогатого скота / Д. Н. Кольцов [и др.].// Сб. мат. междунар. научно-практ. конф. «Научные основы повышения продуктивности сельскохозяйственных животных». Ч. 1, Краснодар, 2011. - с. 18-20.
12. Омельченко, Н.А. Воздействие пробиотиков на молочную продуктивность коров /Н.А. Омельченко, Н. А. Юрина, Д. А. Юрин, С. И. Кононенко//В сборнике: ИННОВАЦИОННЫЕ ПОДХОДЫ В ВЕТЕРИНАРНОЙ И ЗООТЕХНИЧЕСКОЙ НАУКЕ И ПРАКТИКЕ. - 2016. - С. 263-267.
13. Система иммуногенетических маркеров при совершенствовании новых молочных типов бурого швицко-го и сычевского скота: практическое руководство / В. К. Чернушенко [и др.]. - Смоленск: Смоленская городская типография, 2010. - 50 с.
14. Чернушенко, В. К. Повышение эффекта селекции молочного скота при использовании иммуногенетических маркеров, дисс. на соискание уч. степени д-ра с. - х. наук/ В. К. Чернушенко. - Смоленск: 1992. - 316 с.
15. Щепкин, М. М. Из наблюдений и дум заводчика/ М. М. Щепкин. - М.: Сельхозгиз, 1947. - с. 46-47.
16. Эрнст, Л. К. Биологические проблемы животноводства в XXI веке/ Л. К. Эрнст, Н. А. Зиновьева. - М.: РАСХН, 2008. - 508 с.
УДК 633.71:631.52 UDC 633.71:631.52
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ IMPROVING OF THE EFFICIENCY IN АГРОПРОИЗВОДСТВА СОРТОВ AGRICULTURAL PRODUCTION OF ТАБАКА TOBACCO VARIETIES
A.А. Саввин , науч. сотр., Savvin A.A., Researcher
B.Ф. Шульга, ст. науч. сотр. Shulga V.F., Senior Researcher ФГБНУ ВНИИТТИ FSBSI ARSRITTP
Важнейшей проблемой экономиче- The most important problem of Russian ского развития табачной отрасли economic development of the tobacco России в условиях интеграции в ми- industry in the conditions of integration ровые хозяйственные связи, включая into the world economic relations, созданный в 2014 г. Таможенный Ев- including established in 2014 Customs разийский экономический союз, явля Eurasian Economic Union is the
НЕКОТОРЫЕ ПОДХОДЫ К СТАТИСТИЧЕСКОЙ ОБРАБОТКЕ ПОЛИМОРФНЫХ ИММУНОГЕНЕТИЧЕСКИХ ХАРАКТЕРИСТИК ГРУПП КРОВИ КРУПНОГО РОГАТОГО СКОТА
Герасимова В.Е. 1 , Герасимова Л.А. 2, *, Еремина И.Ю. 3
2 ORCID: 0000-0001-8037-6080,
1, 2 Сибирский университет науки и технологий, Красноярск, Россия;
3 Красноярский аграрный университет, Красноярск, Россия
* Корреспондирующий автор (lyu-gerasimova[at]yandex.ru)
Аннотация
В работе рассмотрены статистические методы сопоставления антигенных показателей одной популяции крупного рогатого скота в разные периоды времени. Оценивались информативность и точность определения разницы совокупности поливариантных параметров разными методами статистической обработки. Установлено, что в то время как коэффициент корреляции не показывал достоверных отличий, двухвыборочный t-критерий Стьюдента для парных выборок уловил отличия между совокупностями. Особенно чувствителен метод расчета критерия Стьюдента для сравнения изменений по отдельным сортировкам антигенов групп крови. Таким образом, данный метод позволяет статистически подтвердить и выявить изменения генетической структуры популяции.
Ключевые слова: иммуногенетические характеристики, группы крови крупного рогатого скота, антиген-частотные показатели, достоверность отличий, коэффициент корреляции, двухвыборочный t-критерий Стьюдента.
SOME APPROACHES TO STATISTICAL TREATMENT OF POLYMORPHIC IMMUNOGENETIC CHARACTERISTICS OF BLOOD GROUPS OF CATTLE
Gerasimova V.E. 1 , Gerasimova L.A. 2, *, Eremina I.Yu. 3
2 ORCID: 0000-0001-8037-6080,
1, 2 Siberian State Aerospace University, Krasnoyarsk, Russia;
3 Krasnoyarsk Agrarian University, Krasnoyarsk, Russia
* Correspondent author (lyu-gerasimova[at]yandex.ru)
Abstract
The paper discusses statistical methods for comparing antigenic indicators of a single cattle population in different periods of time. The information content and accuracy of determining the difference of the set of polyvariant parameters were evaluated by different statistical processing methods. It was established that while the correlation coefficient did not show significant differences, the two-sample Student’s t-test for paired samples caught differences between the aggregates. The method of calculating student’s criterion for comparing changes in the individual screening of blood group antigens is especially sensitive. Therefore, this method allows statistically confirming and identifying changes in the genetic structure of a population.
Keywords: immunogenetic characteristics, blood groups of cattle, antigen-frequency parameters, authenticity of differences, correlation coefficient, two-sample Student’s t-test.
Особенности иммуногенетических характеристик групп крови крупного рогатого скота заключаются в их высокой вариабельности, разнородности и корреляцией с хозяйственно-полезными признаками. С одной стороны, это качественные показатели – анализируются 65 антигенов групп крови, которые могут присутствовать у каждого животного практически в любых комбинациях. С другой стороны каждый антиген в исследуемой группе животных наблюдается с определенной, характерной для него частотой, что является количественной характеристикой. Частоты встречаемости антигенов групп крови могут быть весьма специфическим и показательным средством описания выборки – изучаемой группы животных. В качестве выборки обычно принимают популяцию животных, а для крупного рогатого скота – поголовье конкретного хозяйства, что также можно отнести к категории популяций. Таким образом, антиген-частотные показатели помогают оценить популяционные процессы происходящие под давлением естественного и искусственного отбора в процессе селекции. Они могут быть использованы как для характеристики внутрипопуляционных (внутригрупповых) процессов, так и для описания межпопуляционных (больших групп, пород) отличий [1], [2], [3], [4].
Цель работы – оценить популяционные процессы, происходящие под воздействием селекционного давления на основе анализа иммуногенетических характеристик групп крови крупного рогатого скота. В ходе выполнения исследования решались задачи: 1) обоснование выбора статистического метода для выявления микропопуляционных процессов на основе антиген-частотных характеристик крупного рогатого скота; 2) расчет статистических показателей на примере конкретных стад; 3) биологическая интерпретация полученных статистических показателей относительно происходящих популяционных процессов на примере реальных данных.
Проводились сравнения данных по популяции за 3 периода – базовое стадо (исходные данные) и уже измененное в ходе селекции стадо с интервалом рождения животных через 5 лет и 3 года, которые условно обозначили как период 1, 2 и 3. Следовательно, временной интервал между данными по популяции за период 1 и 3 составляет 8-10 лет. Исходя из специфики ведения селекционной работы предполагаем, что популяция периода 1 будет иметь некоторые, возможно не очень значительные отличия, по сравнению с периодом 2 и существенные изменения по отношению к периоду 3. При этом характеристики популяции периодов 2 и 3 будут весьма близки. Численность анализируемого поголовья составляла 214, 435 и 170 голов по периодам 1, 2 и 3 соответственно.
Для сравнения изменений состояния популяции в целом, по всему комплексу антигенов, как правило, используется коэффициент корреляции [5], [6], [7], [8]. Коэффициент корреляции между состояниями популяции всех трех периодов близок к 1, что свидетельствует о наличии высокой степени прямой взаимосвязи между рядами частот в разные периоды времени, то есть по частоте антигена одного года можно спрогнозировать значения частоты данного антигена в другой изучаемый период. Причем, ожидаемо, связь между частотами периодов 2 и 3 более тесная, чем связь между данными этих же периодов с частотами за период 1. Результаты представлены в таблице 1.
Таблица 1 – Значения коэффициента корреляции между разными периодами
| Исследуемые периоды | 2 | 3 |
| 1 | 0,847176 | 0,823361 |
| 2 | 0,904633 |
Таким образом, коэффициент корреляции не выявил значительных различий по антиген-частотным характеристикам стада в интервале почти 10 лет, хотя наблюдается тенденция по снижению уровня корреляции с увеличением временного разрыва между популяцией изучаемых периодов.
Логично предположить, что с учетом постоянно проводимого селекционного процесса, в ходе которого в популяцию вводятся новые генотипы, изменения в составе антигенов должны быть. И действительно значения частот антигенов существенно изменяются. Тем не менее, базовый генофонд популяции также сохраняет свое влияние. Следовательно, возникает необходимость выявить и оценить скорость и масштаб этих изменений. При этом, учитывая общность базового генофонда, выборки в разные временные периоды рассматриваются как зависимые совокупности.
Для того, чтобы установить наличие или отсутствие различий между частотами антигенов в одной популяции в разных периодах необходимо проверить однородность данных характеристик, то есть установить из одной генеральной совокупности или из разных взяты два ряда частот антигенов. Поскольку исследования проводятся по антигенам в одной популяции животных, то выборки частот зависимы. Каждому антигену соответствует частота встречаемости в популяции в каждом из исследуемых периодов, что обуславливает парность рядов данных. В этом случае целесообразно использовать двухвыборочный t-критерий Стьюдента для зависимых (парных) выборок [5], [7], [8], [9], [10], который позволяет идентифицировать однородны ли два ряда антигенов или различны.
Для расчета эмпирического значения t-критерия вычисляется разница между частотами каждого антигена в ряду
![]()
где zi – разница частот i-ого антигена в разные периоды, p1i – частота i-ого антигена в период 1, p2i – частота i-ого антигена в период 2, k – количество антигенов в частотном ряду.
Далее вычисляется среднее и разница между частотами антигенов

где ![]()
– среднее значение разности частот антигенов, k – количество антигенов в частотном ряду, sz – стандартное отклонение разностей.
Аналогично рассчитывается ![]()
для периодов 2-3 и 1-3.
Рассматривается нулевая гипотеза об отсутствии различий (об однородности) в двух рядах частот, то есть о равенстве нулю среднего значения разницы частот ![]()
и альтернативная гипотеза о различии в двух рядов частот, то есть о неравенстве нулю среднего значения разницы частот ![]()
Эмпирическое значение двухвыборочного t-критерия Стьюдента для зависимых (парных) выборок:
![]()
Эта статистика имеет распределение t (k-1). Вычисленное значение t сравнивается с табличным tкр при (k-1) числе степеней свободы и заданном уровне значимости.
Если модуль расчетного значения критерия меньше табличного |t\ tкр, то нулевая гипотеза отвергается и принимается альтернативная гипотеза о различии в двух рядов частот, делается вывод о том, что два ряда частот антигенов различны.
В данной работе устанавливалось наличие или отсутствие различий между частотами всех рассматриваемых антигенов в различных периодах.
Таблица 2 – Использование t-критерия Стьюдента для сравнения популяций по всей совокупности антигенов
| Исследуемые периоды | 2 | 3 |
| 1 | отличия есть | отличия есть |
| 2 | отличий нет |
Из таблицы 2 видно, что по всей совокупности антигенов групп крови двухвыборочный t-критерий Стьюдента выявил отличия между иммуногенетическими характеристиками популяции между периодами 1-2 и 1-3, что соответствует первоначальному предположению.
Кроме того, в исследовании необходимо было установить наличие или отсутствие различий между частотами антигенов в классах (по генетическим системам групп крови). У крупного рогатого скота существует несколько поливариантных систем групп крови. В исследуемой популяции выделены 5 таких систем по 2, 6, 7, 10 и 34 антигена. Все исследуемые антигены разбивали на классы в соответствии с системами групп крови и далее для каждого класса антигенов рассматривали вопрос об однородности (или различии) между рядами частот антигенов в разных периодах, то есть сравнивали ряды антигенов одной системы группы крови, полученные в популяции, находящейся в разных временных периодах. По системам, представленным не более 10 антигенами, статистически достоверных отличий не выявлено. Достоверные отличия были определены только по самой многофакторной системе, включающей 34 антигена (EAB-система), причем с уровнями достоверности 95 и 99% (табл.3).
Таблица 3 – Выявление внутрипопуляционных изменений на основании антигенных отличий по EAB -системе групп крови
| Показатели | Значения t-критерия | Наличие отличий |
| Порог достоверности 95% | 2,03 | |
| Порог достоверности 99% | 2,73 | |
| Между периодами 1-2 | 2,62 | Есть, достоверность 95% |
| Между периодами 1-3 | 3,49 | Есть, достоверность 95%, 99% |
| Между периодами 2-3 | 2,61 | Есть, достоверность 95% |
В таблице 3 показаны ярко выраженные межпопуляционные отличия по EAB-системе между периодами 1 и 3. Наглядно видны изменения генетической структуры между наиболее отдаленными по времени состояниями популяции. Популяции, близкие во временных рамках, проявили отличия лишь с порогом достоверности 95%. Таким образом, мы можем отметить начальные этапы генетической дивергенции, которая со временем только усиливается, что объясняется действием направленного отбора. Очевидно, антигены полифакторной ЕАВ-системы групп крови подвергаются наибольшему давлению отбора в ходе селекционного процесса, то есть, вероятно, более активно коррелируют с хозяйственно-полезными признаками.
Кроме того, в исследовании устанавливалось наличие или отсутствие различий между частотами внутри сортированных групп антигенов. В каждой из трех совокупностей антигены ранжируются по значениям частот встречаемости. Все исследуемые антигены разбивали на классы: редко встречающиеся и элиминирующиеся, часто встречающиеся и средние с порогами встречаемости 0-15%, свыше 50% и 16-50% соответственно.
В связи с тем, что в каждом из исследуемых периодов разделение антигенов на данные группы различно, рассмотрим сравнение частот групп антигенов отдельно для каждого периода. То есть, сначала для каждого из исследуемых периодов делается разбиение всех антигенов на группы и оно считается базовым. Далее при базовом разделении антигенов на группы рассматривается вопрос об однородности или различии рядов частот каждой группы антигенов с соответствующими рядами частот этих же антигенов в другом (не являющимся базовым) периоде. Следует отметить, что в частотные классы в разные периоды попадает разное число антигенов и они отличаются по своему качественному составу.
При анализе, когда за базовый приняли период 1 и попарно сравнивали частотные классы с аналогичными показателями периодов 2 и 3, получили достоверно статистически подтвержденные отличия с обеими периодами в группе редко встречающихся антигенов, что тоже показательно. Редковстречающиеся и элиминирующиеся антигены представляют собой группу вымываемых отбором, т.е. не поддерживаемую селекцией и экологическими факторами часть генофонда.
При базовом периоде 2, логично не выявлено отличий с частотными классами периодов 1 и 3.
Сравнение периода 3 с данными периодов 1 и 2 достоверные отличия отмечены по классу средне встречающихся антигенов только с периодом 1.
Во всех остальных случаях отличий не определено.
Заключение
Двухвыборочный t-критерий Стьюдента максимально информативен для оценки изменений генетической структуры популяции на начальных этапах их развития.
Коэффициент корреляции не улавливает начальные уровни дивергенции популяционных признаков.
Популяционные процессы наиболее отчетливо проявляются по антиген-частотным характеристикам ЕАВ-системы групп крови.
Классы антигенов по частотам встречаемости проявляют характерные отличительные признаки только между отдаленными периодами.
Класс редко встречающихся антигенов можно рассматривать, как показательный для выявления кумуляции отличий.
Список литературы / References
- Букаров Н. Генетический мониторинг в молочном скотоводстве с использованием маркерных групп крови / Букаров Н., Силкин С. // Молочное и мясное скотоводство. – 2011. – №. 7. – С. 14-16.
- Тихонов В. Н. Мониторинг микроэволюции и породообразования свиней на основе молекулярно-иммуногенетического анализа / Тихонов В. Н., Бобович В. Е. // Сельскохозяйственная биология. – 2004. – №. 2. – С. 10-27.
- Еремина И. Ю. Ретроспективный анализ филогенеза при формировании маточной субпопуляции голштинизированного молочного скота Красноярского края / Еремина И. Ю., Герасимова Л. А., Лущенко А. Е. // Вестник Омского государственного аграрного университета. – 2016. – №. 2 (22)
- Никитин С. В. Динамика гетерозиготности и ее связь с приспособленностью в популяции домашних свиней // Генетика. – 2009. – Т. 45. – №. 10. – С. 1401-1410.
- Айвазян С. А. Теория вероятностей и прикладная статистика. Т. 1. / Прикладная статистика. Основы эконометрики: Учебник для вузов: В 2 т. 2-е изд., испр. / С. А. Айвазян,В. С. Мхитарян. – Москва: Юнити-Дана, 2001, 656 с.
- Венцель Е.С. Теория вероятностей: Учеб. пособие для студентов вузов. / Е.С. Венцель, Л.А. Овчаров. – М:.-1969
- Гмурман В.Е. Руководство к решению задач по теории вероятностей и математической статистике: Учеб. пособие для студентов вузов / В.Е. Гмурман. – М.: Высш. школа, 1979. 400 с.
- Кремер Н.Ш. Теория вероятностей и математическая статистика: Учеб. пособие для студентов вузов. / Н.Ш. Кремер. – М:.-2004
- Рубан А.И., Методы анализа данных / А.И. Рубан. – Красноярск 1993.
- Хижняк С.В. Математические методы в биологии и экологии: часть 3. Учебно-методическое пособие. / С.В. Хижняк. – Красноярск, 2005.
Список литературы на английском языке / References in English
Читайте также:

